- この論文のまとめ
- 一言で言うと:顕微鏡的多発血管炎(MPA)・多発血管炎性肉芽腫症(GPA)において、RTXと併用の上で、ステロイドはかなり減量して寛解導入しても治療可能かもしれない。
- 背景:
- ステロイドは副作用が多いので少ない方がよい。
- 重症(重度腎障害・肺胞出血)のMPA/GPAにおいてはPEXIVAS trialによって、ステロイドを減量して寛解導入できる可能性が示唆された。
- MPA/GPAにおいてはRITUXIVAS trialによって、寛解導入療法でのリツキシマブ(RTX)もシクロホスファミドと同様の効果が期待できる。
- 目的:PEXIVASは重症(重度腎障害・肺胞出血)患者に対しての研究なので、より軽症ならばRTXを併用しつつ、より少ないプレドニンで、寛解導入できることを証明すること。
- 結果:ステロイドの減量レジメンでも、通常レジメンと同等の効果があり、かつ副作用は少なかった。
- 解釈:非重症腎障害のあるMPA/GPAにおいては、RTXを併用のうえで、少ないステロイド量で寛解導入を達成できる可能性がある
Low-dose glucocorticoids plus rituximab versus high-dose glucocorticoids plus rituximab for remission induction in ANCA-associated vasculitis (LoVAS): protocol for a multicentre, open-label, randomised controlled trial
Shunsuke Furuta, Takao Sugiyama, Takeshi Umibe, Yuko Kaneko, Koichi Amano, Kazuhiro Kurasawa, Daiki Nakagomi, Masaki Hiraguri, Hideki Hanaoka, Yasunori Sato, Kei Ikeda, Hiroshi Nakajima, on behalf of the LoVAS Trial study investigators
BMJ Open 2017;7:e018748.
Introduction
わかっていること
- ANCA関連血管炎(AAV)は小~中血管の血管炎を特徴とする
- 未治療患者の1年死亡率は80%
- 過去20年の無作為化比較試験により、高用量グルココルチコイドとシクロホスファミドの併用が現在の標準治療
- この併用療法は80-90%の高い寛解率を達成し、5年死亡率を25%に低減
- しかし、感染症や心血管疾患による死亡など様々な副作用が関連
- AAVの病態におけるB細胞の重要性が広く知られている
- RAVE試験とRITUXVAS試験(2010年)は、高用量グルココルチコイドとの併用において、リツキシマブとシクロホスファミドが同等の寛解率を示すことを実証
- これらの試験では、リツキシマブ群とシクロホスファミド群で同様の安全性プロファイルが報告され、高用量グルココルチコイドが有害事象の主な原因であることが示唆された
- 高用量グルココルチコイドとリツキシマブの併用は、AAVの寛解導入のもう一つの標準治療として確立されている
わかっていないこと
- AAVにおける有害事象を減少させる新しい治療法が必要
- グルココルチコイド用量の低減が可能性の一つ
- 従来の免疫抑制剤との併用における低用量グルココルチコイドのレジメンに関する過去の観察研究とメタ解析では、寛解導入期の低用量グルココルチコイドは再発率の上昇と関連していた
- しかし、これらの研究にはリツキシマブ治療を受けたAAV患者のデータは含まれていない
- 後ろ向き観察研究では、低用量グルココルチコイドとリツキシマブの併用が再発例の再寛解を導入できることが示唆されている
今回の研究目的
AAVの寛解導入において、リツキシマブと併用した場合に、低用量グルココルチコイドレジメンが高用量レジメンに対して寛解率において非劣性であるという仮説を検証すること
Method
Setting
- 日本の34の三次医療機関のリウマチ科・腎臓内科センター
研究デザインのType
- 第IV相多施設共同オープンラベル無作為化比較試験
Inclusion criteria
- 20歳以上
- 2012年Chapel Hill Conference定義によるANCA関連血管炎(MPA、GPA、腎限局型血管炎)の新規診断
- ELISA、CLEIA、またはFEIA法でMPO-ANCAまたはPR3-ANCAが陽性
Exclusion criteria
- 試験参加同意前のANCA関連血管炎に対する治療歴
- eGFR <15mL/minの糸球体腎炎、または2L/分以上の酸素吸入を要する肺胞出血
- 併存疾患としての他の全身性自己免疫疾患
- 重度の症状がなくグルココルチコイド療法を必要としないRA、強皮症、シェーグレン症候群患者は除外しない)
- グルココルチコイド、免疫抑制剤、生物学的製剤、血漿交換、または高用量ガンマグロブリン療法の使用を必要とする可能性がある併存疾患(注:経口グルココルチコイドを必要としない良好にコントロールされた気管支喘息患者は参加可能
介入
寛解導入期(両群共通):
- リツキシマブ:375mg/m²/週、静脈内投与、4回
- 初回投与は1~7日目の間に実施
- 初回投与時の前投薬(必須):アセトアミノフェン経口、ジフェンヒドラミン経口、メチルプレドニゾロン125mg静注
- 2回目以降の前投薬は必須ではなく各施設判断
推奨される併用薬(禁忌がない場合):
- 消化性潰瘍予防のプロトンポンプ阻害薬
- 骨粗鬆症予防のビスホスホネート、ビタミンD製剤、カルシウム製剤
- ニューモシスチス肺炎予防のトリメトプリム・スルファメトキサゾール配合剤
寛解維持期(両群共通):
- リツキシマブ:1g/bodyを6ヶ月毎(6、12、18ヶ月)に投与
↓ステロイド投与レジメンの量。ANCA関連血管炎診療ガイドライン2023より抜粋。
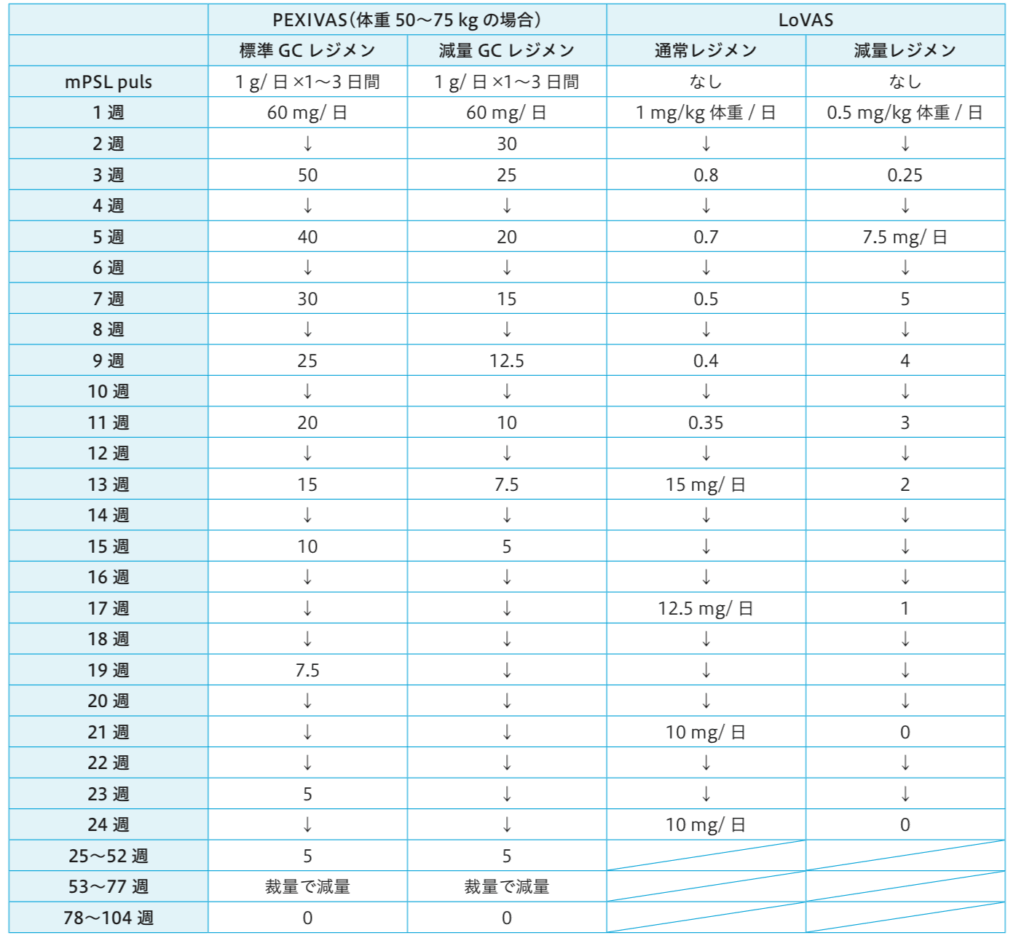
プレドニゾロンの減量延期
減量レジメンにおいて、5mg/day以下の、14週かけてプレドニゾロンを中止するレジメンを、最終減量ステップと呼ぶ。この最終減量ステップの開始を、以下の条件の場合に、延期することができる。
- 条件
- BVASスコアが0に達していない
- CRP値が正常化していない
- ANCA値が正常化していない
- ステップの開始を延期できるだけで、ステップ自体のスケジュルは変更しない。
主要アウトカム
6ヶ月時点での寛解率
- 寛解の定義:BVAS version 3スコアが0(または全て持続項目で≤1)、かつ経口プレドニゾロン≤10mg/日
副次アウトカム
- 寛解までの期間
- 死亡までの時間
- 再発までの時間
- 末期腎不全までの時間
- 最初の重篤な有害事象までの時間
- 死亡の割合
- 再発の割合
- 末期腎不全の割合
安全性
- 重篤な有害事象の数
- 重篤な有害事象を有する参加者の割合
- グルココルチコイド関連副作用として特に評価される項目:
- 新規発症糖尿病
- 高血圧
- 脂質異常症
- 不眠
- 骨折
- 感染症
解析方法
サンプルサイズ計算:
- RITUXVAS試験と Cambridge University cohortに基づき、両治療群で80%の患者が6ヶ月時点で寛解達成すると仮定
- 非劣性マージンを-20%ポイントと設定
- 片側α=0.025
- 10%の脱落率を仮定
- 非劣性を実証するための80%の統計的検出力を得るため、各群70名(計140名)が必要
統計解析:
- CONSORT声明ガイドラインに従って実施
- 全ての有効性解析は主にFull Analysis Set(試験治療を少なくとも1回受けたすべての患者)に基づく
ベースライン変数:
- カテゴリカルデータ:頻度と割合
- 連続変数:平均とSD
- 比較:カテゴリカルアウトカムにはPearsonのχ²検定またはFisherの正確検定、連続変数にはWilcoxon順位和検定
主要解析:
- 6ヶ月時点での寛解導入率のリスク差とその95%信頼区間をWald統計量に基づく方法で推定
- 両側95%信頼区間の下限が-0.2を超える場合、非劣性が統計学的に証明されたとみなす
- 感度解析:Mantel-Haenszel法による調整リスク差を推定
- 調整因子:同意時の年齢、eGFR、ANCA
その他:
- 全ての比較は事前に計画
- 全てのP値は両側
- P値<0.05を統計学的に有意とみなす
- 全ての統計解析はSAS V.9.4を使用
- データベースロック前に統計解析計画を確定
Result
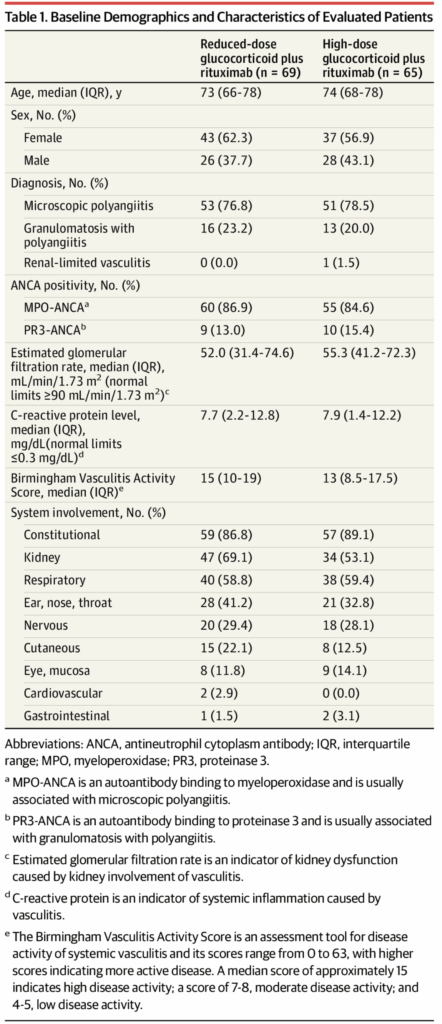
研究対象者
2014年11月から2019年6月の間に、ANCA関連血管炎患者140名が本研究に登録された。
- 低用量群:70名が割り付けられた
- 高用量群:70名が割り付けられた
ベースライン特性は両群間で同等であった。
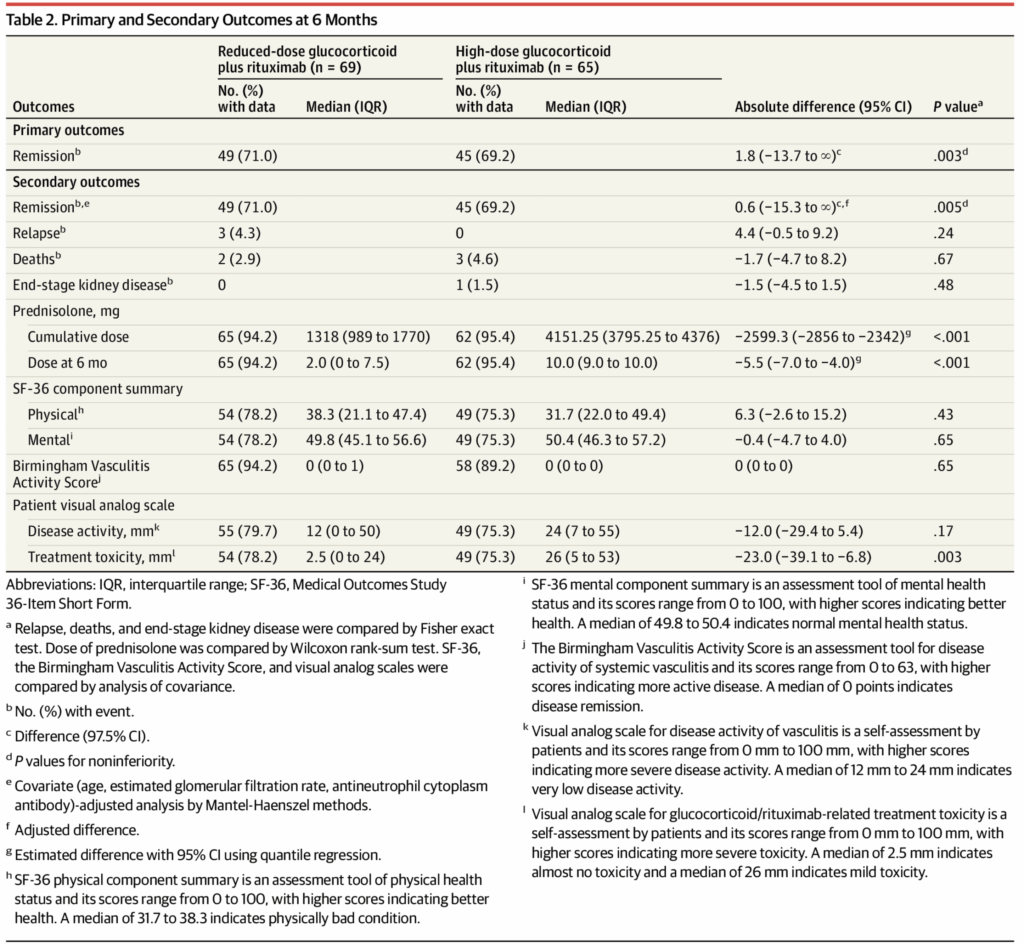
主要評価項目
6ヶ月時点での寛解率:
- 低用量群:49名(71.0%)
- 高用量群:45名(69.2%)
- 非劣性が証明された
副次評価項目
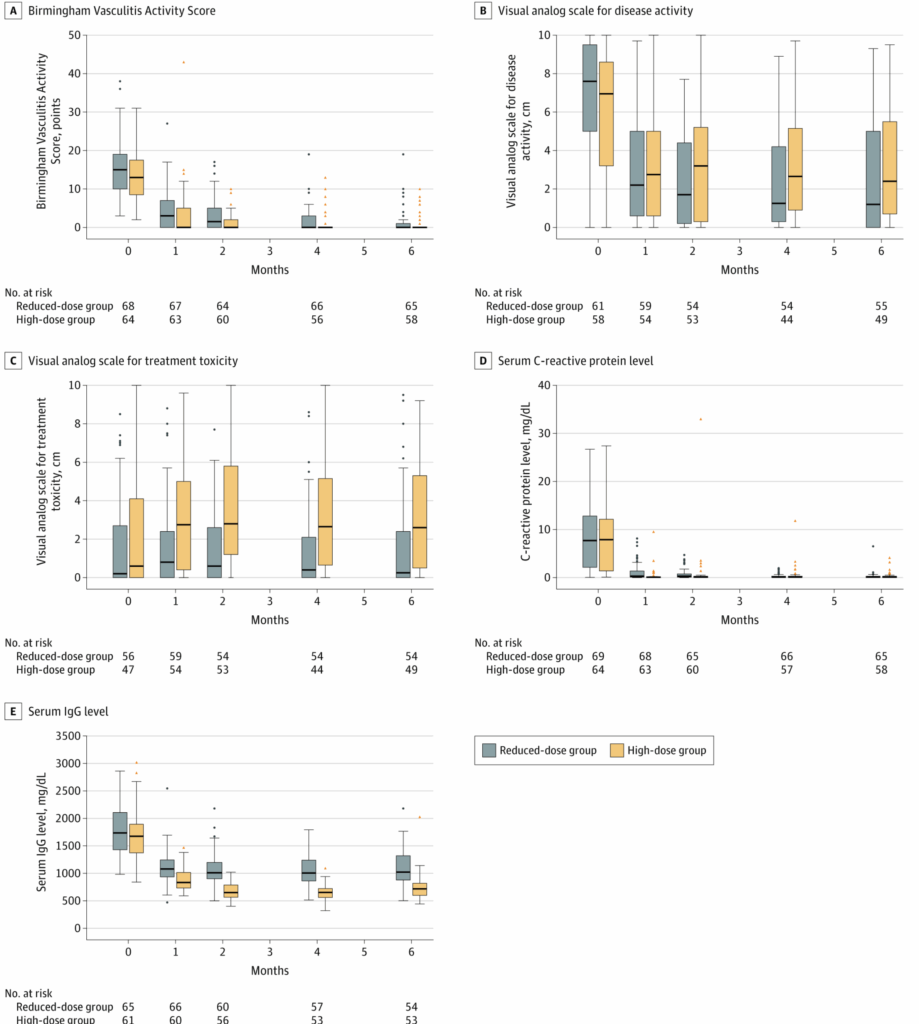
- 寛解に至らなかった患者
- 低用量群:6名がプロトコル治療を完遂したが寛解せず
- 高用量群:8名がプロトコル治療を完遂したが寛解せず
- 治療変更
- 低用量群:9名が不十分な反応のため治療を変更(うち7名が6ヶ月時点で寛解)
- 高用量群:8名が治療を変更(リツキシマブの重度の注入反応1名、腸穿孔1名を含む)(うち5名が6ヶ月時点で寛解)
- 早期再発(6ヶ月以内)
- 低用量群:3名(4.3%)(主要再発1名、軽度再発2名)
- 高用量群:0名
- リスク差:4.3%(95% CI, −0.5%~9.3%)、P = .24(有意差なし)
- 死亡
- 低用量群:2名(2.9%)
- 原因不明の突然死(79歳、50日目)
- くも膜下出血(58歳、14日目)
- 高用量群:3名(4.6%)
- 敗血症(80歳、32日目)
- 消化管出血2名(75歳、105日目;85歳、12日目)
- リスク差:−1.7%(95% CI, −4.7%~8.2%)、P = .67(有意差なし)
- 低用量群:2名(2.9%)
- 6ヶ月累積生存率:
- 低用量群:97.1%
- 高用量群:95.3%
- リスク差:1.7%(95% CI, −4.7%~8.2%)、P = .58(有意差なし)
- 末期腎不全(ESKD)
- 低用量群:0名
- 高用量群:1名(1.5%)
- リスク差:−1.5%(95% CI, −4.5%~1.5%)、P = .48(有意差なし)
- プレドニゾロン投与量
- 6ヶ月間の累積投与量中央値:
- 低用量群:1318 mg
- 高用量群:4151.25 mg
- 差:−2599.3 mg(95% CI, −2856.6~−2342.0)、P < .001
- 6ヶ月時点の投与量中央値:
- 低用量群:2 mg/日
- 高用量群:10 mg/日
- 差:−5.5 mg(95% CI, −7~−4)、P < .001
- 6ヶ月間の累積投与量中央値:
- プレドニゾロン完全中止: 低用量群で27名(39.1%)が6ヶ月までに達成
- 減量の延期: 低用量群の22名がANCA力価上昇(17名)、BVASスコア>1(11名)、CRP上昇(6名)により最終減量ステップを延期
- 生活の質(QOL)6ヶ月時点のSF-36:
- 身体的要素サマリー:差6.3(95% CI, −2.6~15.2)、P = .43(有意差なし)
- 精神的要素サマリー:差−0.4(95% CI, −4.7~4.0)、P = .65(有意差なし)
- 疾患活動性とその他の評価
- BVASスコア(6ヶ月): 両群とも中央値0、差0(95% CI, 0~0)、P = .65(有意差なし)
- 患者VAS(疾患活動性、6ヶ月):
- 低用量群:中央値12 mm
- 高用量群:中央値24 mm
- 差:−12 mm(95% CI, −29.4~5.4)、P = .17(有意差なし)
- 患者VAS(治療毒性、6ヶ月):
- 低用量群:中央値2.5 mm
- 高用量群:中央値26 mm
- 差:−23 mm(95% CI, −39.1~−6.8)、P = .003
- 臨床検査値
- CRP(6ヶ月): 差−0.06 mg/dL(95% CI, −0.22~0.35)、P = .67(有意差なし)
- eGFR(6ヶ月): 差3.2 mg/min/1.73 m²(95% CI, −5.9~12.2)、P = .69(有意差なし)
- 血清IgG(6ヶ月):
- 両群で導入後に低下
- 低用量群が高用量群より高値
- 差:245.9 mg/dL(95% CI, 91.6~400.2)、P < .001
- B細胞: リツキシマブを投与された全患者でB細胞枯渇を達成
Adverse Effect
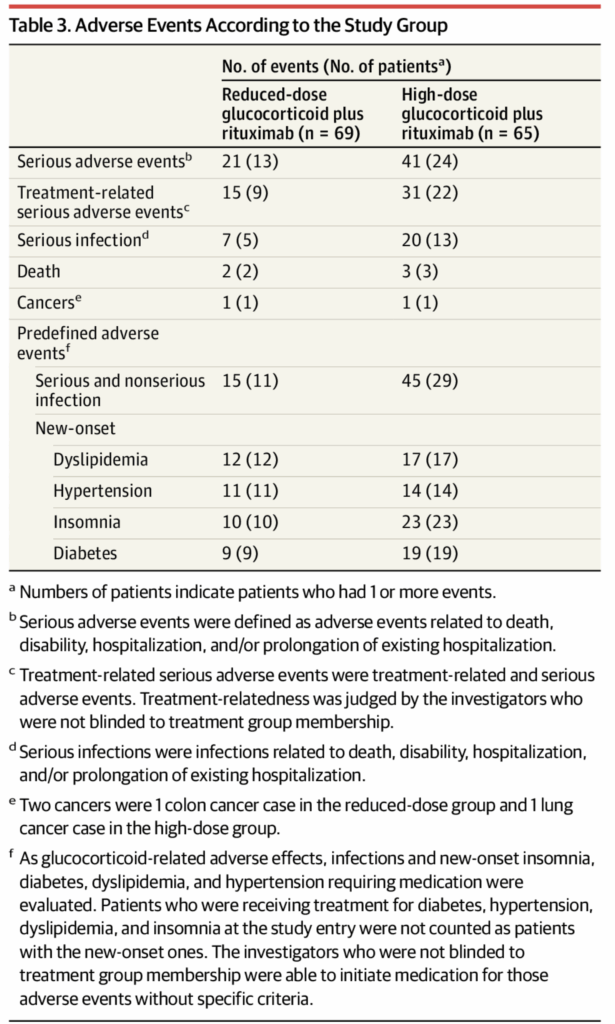
- 重篤な有害事象
- 低用量群:13名(18.8%)で21イベント
- 高用量群:24名(36.9%)で41イベント
- リスク差:−18.1%(95% CI, −33.0%~−3.2%)、P = .02
- 重篤な感染症
- 低用量群:5名(7.2%)で7イベント
- 高用量群:13名(20.0%)で20イベント
- リスク差:−12.8%(95% CI, −24.2%~−1.3%)、P = .04
- 日和見感染症
- 高用量群:水痘1名、粟粒結核1名、侵襲性アスペルギルス症2名
- 低用量群:ニューモシスチス肺炎2名(予防投与を受けていなかった)
- 事前定義されたグルココルチコイド関連有害事象
- 糖尿病: リスク差−20.8%(95% CI, −34.8%~−6.8%)、P < .001
- 不眠: リスク差−16.2%(95% CI −29.8%~−2.6%)、P = .02
- 全感染症: リスク差−28.7%(95% CI −43.5%~−13.8%)、P < .001
- いずれも低用量群で有意に低頻度
- その他
- がん: 2名(低用量群で2ヶ月時点に結腸癌1名、高用量群で1ヶ月時点に肺癌1名)
- Vasculitis Damage Index(6ヶ月): 差−0.1(95% CI, −0.7~0.4)、P = .62(有意差なし)
- サブグループ解析・感度解析
- 年齢、eGFR値、ANCA亜型による主要アウトカムのサブグループ解析:統計学的に有意な交互作用なし
- 施設をランダム効果とした混合効果モデルによる寛解のオッズ比:1.09(95% CI, 0.51~2.31)、P = .82
- 感度解析は主要解析の結果を支持
調整解析(ANCA亜型、年齢、腎機能で調整、Mantel-Haenszel法)でも主要比較に影響なし。
Discussion
結果の解釈
新規診断のANCA関連血管炎患者を対象としたこの無作為化臨床試験において、リツキシマブと併用した場合、減量プレドニゾロンレジメンは6ヶ月時点の疾患寛解率に関して従来の高用量プレドニゾロンレジメンに対して非劣性であった。 減量プレドニゾロンは、重篤な感染症を含む重篤な有害事象、および事前定義されたグルココルチコイド関連副作用を有意に減少させた。
患者指向アウトカム
従来の評価項目に加え、患者VASも患者指向アウトカムとして評価された。患者VASは、効果的な治療法の開発において必須の要素としてますます重視されている。疾患活動性に関する患者VASは6ヶ月時点で両群間に有意差がなかったが、治療毒性に関する患者VASは低用量群が高用量群と比較して有意に良好であった。患者VASはANCA関連血管炎の試験では検証されていないが、本試験では他の評価項目と一致した結果であった。
PEXIVAS試験との比較:
- 補足
- 日本人ではMPAがGPAに比べてかなり多いので、MPO-ANCA陽性率が高い。
- PEXIVASのベースのCre 3.7mg/dL程度(330μmol/L)で、LoVASではeGFR 50程度と、ベースの腎機能は大きく異なる
- LoVASが全例RTXに対して、PEXIVASは8割以上がIVCY・POCY
- Primary outcomeが、PEXIVASは死亡・末期腎不全だが、LoVASでは寛解としている。
最近、PEXIVAS試験の結果が公表された。これは2×2要因デザインを用いて、最重症のANCA関連血管炎患者(血清クレアチニン中央値327 μmol/L)において血漿交換と迅速または標準的グルココルチコイド漸減を評価した。研究者らは、死亡またはESKDに関して迅速漸減が標準漸減に対して非劣性であると報告した。
本試験とPEXIVAS試験は寛解導入期のグルココルチコイド用量削減という概念を共有しているが、両試験には明確な違いがある:
患者集団:
- 本試験:年齢中央値73歳、MPO-ANCA陽性率85.8%
- PEXIVAS試験:年齢中央値63歳、MPO-ANCA陽性率59.4%
除外/組入基準:
- 本試験:重度の糸球体腎炎(eGFR <15 mL/min/1.73 m²)と肺胞出血(2L/分超の酸素吸入)を除外
- PEXIVAS試験:重度の糸球体腎炎(eGFR <50 mL/min/1.73 m²)および/または肺胞出血患者に限定
プレドニゾロン用量:
- 本試験:より低用量
- PEXIVAS試験:迅速漸減レジメンでもはるかに高用量
メチルプレドニゾロンパルス療法:
- 本試験:許可せず
- PEXIVAS試験:全患者に投与
免疫抑制剤:
- 本試験:全患者にリツキシマブ
- PEXIVAS試験:シクロホスファミド(経口・点滴)またはリツキシマブを臨床判断で
異なる患者集団で同様の結果が得られたことは、減量プレドニゾロンレジメンを支持する知見の一般化可能性を高める。
RITAZAREM試験との比較:
- グルココルチコイド用量の選択は各医師の裁量に委ねられたが、RITAZAREM試験は、再発性ANCA関連血管炎において、リツキシマブと併用した場合、開始用量0.5 mg/kg/日の減量プレドニゾロンレジメンが高用量レジメンと同様の寛解率を示すことを示唆した。
- これらの新しい研究と本試験は、併用療法、異なる患者集団にかかわらず、適切で強力な治療と併用した場合、ほとんどのANCA関連血管炎患者において寛解導入期のグルココルチコイド総投与量を削減できることを総合的に実証した。
ADVOCATE試験との比較:
- C5a受容体阻害薬であるavacopanの有効性を評価したADVOCATE試験は、ANCA関連血管炎患者において、avacopanが26週時点の寛解で高用量プレドニゾロンに対して非劣性であり、52週時点の持続的寛解で高用量プレドニゾンより優れていることを実証した。しかし、ADVOCATE試験のavacopan群でも寛解導入期に平均1349 mgのプレドニゾロンを使用しており、これは本試験の低用量群(中央値1318 mg)と同等である。
- さらに、ADVOCATE試験では重篤な有害事象の頻度がavacopan群(37.3%)とプレドニゾロン群(39.0%)で同等であったのに対し、本試験では低用量群(18.8%)が高用量群(36.9%)より低かった。avacopanと本試験の減量プレドニゾロンレジメンを比較する試験が必要である。
プレドニゾロン中止ステップの延期:
- 本試験では、事前定義された条件が満たされ、研究者が持続的な低疾患活動性を疑った場合、低用量群でプレドニゾロン中止ステップの開始延期が許可された。この延期は、低用量群で寛解を達成した49名中22名で発生した。この許容は、早期の完全中止よりもプレドニゾロンの累積投与量を減らすことが研究目的であったため、研究プロトコルに設定された。
- 血管炎症状(BVASスコア)、血清CRP値、ANCA力価の組み合わせが、持続的な低疾患活動性の可能性を評価するツールとして選択された。この組み合わせは日常臨床でしばしば使用されるが、臨床試験の設定では確立されておらず、事前のデータによって十分に裏付けられていない。
- 有害事象に関する所見
- 重篤な有害事象と重篤な感染症が低用量群で減少した。著者らの知る限り、これはANCA関連血管炎において、より低いグルココルチコイド用量が重篤な有害事象を減少させる可能性があることを示した最初の試験である。
- PEXIVAS試験では、重篤な有害事象の頻度は減量群と標準用量群で同等であった。様々な種類の重篤な有害事象のうち、1年以内の重篤な感染症のみがPEXIVAS試験で減量群が標準用量群より低頻度であった。PEXIVAS試験でのメチルプレドニゾロンパルス療法の使用と低いベースライン腎機能が、本試験と異なる結果の原因である可能性がある。
- 重篤な有害事象に加えて、本試験では典型的な早期グルココルチコイド関連副作用のいくつかも評価された。新規発症糖尿病、不眠、感染症は高用量群で低用量群よりも頻繁に観察された。
Limitation
1. オープンラベル試験である
- 患者の外見(クッシング様顔貌など)や血液検査(コレステロール値など)に対する高用量グルココルチコイドの影響を盲検化することは困難であるため、グルココルチコイド介入は盲検化されなかった
- 主要評価項目に関して、BVASスコアは主観的項目と客観的項目の両方から構成される
- BVASスコアに基づく疾患寛解は比較的客観的な評価項目であることが示されているが、一部の要素の主観性によって影響を受ける可能性がある
- 他の評価項目(死亡、ESKD、重篤な有害事象)は客観的である
- しかし、グルココルチコイド関連副作用の評価はオープンラベルデザインによって影響を受ける可能性がある
- 患者がどれだけのプレドニゾロンを投与されたかを知っていることは、グルココルチコイド関連副作用の治療開始に関する研究者の決定や、治療を要する新規発症副作用を有する患者の報告数に影響を与える可能性がある
2. 国際的研究ではなく国内研究である
- 結果として、本試験の疾患表現型は日本人ANCA関連血管炎患者の典型である
- 特徴:顕微鏡的多発血管炎/MPO-ANCA陽性率が高い、肺病変が多い、北米・欧州患者より高齢発症
- しかし、過去の研究では治療反応が日本と他国で同等であることが示されている
- さらに、ほとんどの試験で、ANCA亜型はANCA関連血管炎の寛解導入期の寛解率と関連しないことが示唆されており、本試験の寛解率の一般化可能性を支持
- 一方、多発血管炎性肉芽腫症/PR3-ANCA陽性はより高い再発リスクと関連
- 本試験の再発率の一般化可能性は、顕微鏡的多発血管炎/MPO-ANCA陽性患者に限定される可能性がある
3. グルココルチコイドを必要とする併存疾患のない新規診断患者のみが本試験に含まれた
- すでにグルココルチコイドで治療されている患者が減量レジメンから恩恵を受けるかどうかは不明
4. 本試験における非劣性マージンの設定根拠が弱く、選択されたマージンは広すぎた可能性がある
臨床への影響
結論:
重度の糸球体腎炎または肺胞出血を伴わない新規診断ANCA関連血管炎患者において、減量グルココルチコイドとリツキシマブのレジメンは、6ヶ月時点の疾患寛解導入に関して、高用量グルココルチコイドとリツキシマブのレジメンに対して非劣性であった。
この論文の良い点・悪い点
良い点
- 重要な臨床的エビデンスの提供
- ANCA関連血管炎において、低用量グルココルチコイドとリツキシマブの併用が高用量レジメンに対して非劣性であることを示した最初のRCT
- 重篤な有害事象が有意に減少したことを実証
- 厳格な研究実施
- Good Clinical Practice準拠の独立したモニタリングと監査を実施
- 電子データキャプチャーシステムを使用
- 全患者の記録と原資料の照合を実施
- 患者指向アウトカムの評価
- 従来の臨床的評価項目に加えて、患者VASによる治療毒性の評価を含めた
- 患者の視点からの治療負担の評価を実施
- 明確な非劣性の実証
- 主要評価項目で非劣性が統計学的に証明された(P = .003)
- 感度解析とサブグループ解析でも結果の頑健性が確認された
- 実臨床への配慮
- プレドニゾロン中止の延期を許可する現実的なプロトコル設定
- 日常診療で使用される臨床指標(BVAS、CRP、ANCA力価)の組み合わせを使用
悪い点
- オープンラベルデザイン
- 盲検化されていないため、主観的評価項目(BVASの一部項目、グルココルチコイド関連副作用)にバイアスの可能性
- 研究者が患者の治療群を知っていることが有害事象の報告に影響した可能性
- 一般化可能性の制限
- 日本のみの研究で、疾患表現型が日本人患者の典型(MPO-ANCA陽性、高齢)
- 重度の糸球体腎炎と肺胞出血患者を除外しており、最重症例への適用可能性は不明
- 再発率の一般化可能性はMPA/MPO-ANCA陽性患者に限定される可能性
- 非劣性マージンの設定
- 非劣性マージン(−20パーセントポイント)の設定根拠が弱い
- マージンが広すぎた可能性があり、臨床的に重要な差を見逃す可能性
- 既治療患者への適用不明
- すでにグルココルチコイド治療を受けている患者への効果は不明
- 新規診断患者のみが対象
- プレドニゾロン中止基準の検証不足
- 中止延期の判断に使用した指標の組み合わせ(BVAS、CRP、ANCA力価)は日常臨床で使用されるが、臨床試験の設定では確立されておらず、事前のデータによる十分な裏付けがない



コメント