Rituximab versus azathioprine for maintenance of remission for patients with ANCA-associated vasculitis and relapsing disease: an international randomised controlled trial
Rona M Smith, Rachel B Jones, Ulrich Specks, Simon Bond, Marianna Nodale, et al
Ann Rheum Dis 2023;82:937–944.
Introduction
背景
- 顆粒腫性多発血管炎(GPA)と顕微鏡的多発血管炎(MPA)は、ANCA関連血管炎(AAV)の主要なサブグループである
- 未治療のAAVは、2年以内に93%の死亡率を示し、主に腎不全と呼吸不全が原因である
- グルココルチコイドとシクロホスファミドの導入により生存率が改善し、1年後に80%の患者で寛解導入が可能となった
- リツキシマブはAAVの寛解導入に有効な治療法であり、再発性疾患の治療においてシクロホスファミドより優れている
- RAVE trial ・・・N Engl J Med 2010;363:221–32.
- RITUXIVAS trial ・・・N Engl J Med 2010;363:211–20.
わかっていること
- リツキシマブの固定間隔での反復投与は、MAINRITSAN 1試験において、主に新規診断のAAV患者でシクロホスファミドとグルココルチコイドによる導入後の維持療法としてアザチオプリンより優れていた
- AAVにおけるリツキシマブの長期使用は、感染リスクの増加と低ガンマグロブリン血症の発症と関連している
- 診断後5年以内に50%以上の患者が再発する
- 再発は炎症のさらなるエピソードを反映し、不可逆的な組織損傷、末期腎不全、治療関連毒性、慢性罹患率、死亡率の増加、高い医療費に寄与する
わかっていないこと
- 特に再発の治療において、リツキシマブによる寛解導入後の寛解維持のための最適な戦略は不明である
今回の研究目的
再発性AAV患者において、リツキシマブとグルココルチコイドで寛解再導入後の寛解維持において、固定間隔でのリツキシマブ投与がアザチオプリンより優れているかを評価すること。さらに、リツキシマブの増量が維持治療期間を超えて再発リスクを減少させるという仮説を検証すること。
Method
7カ国29施設(2013年4月〜2016年11月に患者募集、最終患者訪問は2019年11月)
研究デザイン
国際多施設共同ランダム化比較非盲検優越性試験
Inclusion criteria
- 15歳以上
- Chapel Hill Consensus Conference 2012定義に基づくGPAまたはMPAの診断
- PR3-ANCAまたはMPO-ANCAの現在または過去の陽性
- グルココルチコイドと免疫抑制剤の併用療法で寛解達成後の再発
- 再発:BVAS/WGで1つのmajor項目または3つのminor項目で定義
Exclusion criteria
- 他の自己免疫疾患を有する患者
- 注釈)Inclusion・Exclusion criteria
- 末期腎不全や肺胞出血などが含まれているか、除外されているかは不明
介入
導入期(登録〜4ヶ月):
- リツキシマブ375mg/m²/週を4回
- 経口プレドニゾロン/プレドニゾン1.0mg/kg/日(高用量)または0.5mg/kg/日(低用量)で開始し、10mg/日以下まで減量(医師の裁量で選択)
- 静注メチルプレドニゾロン累積3000mgまで許可(登録前2週間または登録後1週間)
維持期(4〜24ヶ月):
- リツキシマブ1000mg静注を4ヶ月ごと(4、8、12、16、20ヶ月時点)に計5回投与
- 血漿IgG<3g/Lの場合は投与保留、次回の投与時点でIgG>3g/Lであれば再開可能
グルココルチコイド:
- 4ヶ月時点での10mg/日以下がランダム化の要件
- 6ヶ月までに5mg/日に減量、16ヶ月まで維持
- その後2.5mg/日に減量し、20ヶ月時点で中止
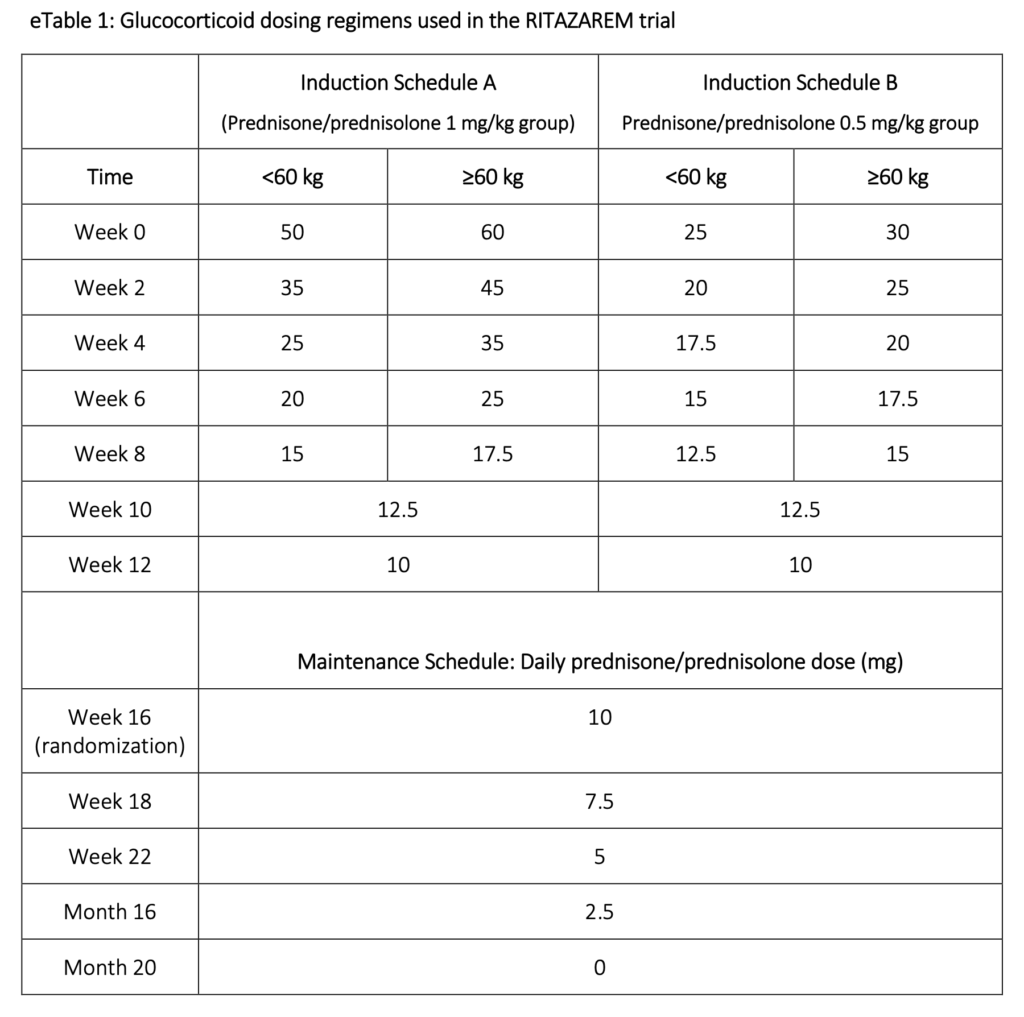
- 注釈)治療のまとめ
- −4〜0週:RTX375mg/m²/週を4回+PSL(パルス ± 高用量 または 低用量)
- 0週:ランダム化
- 0〜20週:RTXを合計5回投与
- 20〜32(最大44ヶ月):RTX投与なしで追跡
- ステロイド投与レジメンについて
- パルスを施行するかは研究者の判断(最大1000mg×3日)
- Schedule A ・・・PEXIVAS trialの標準より少なく、減量より多い
- Schedule B ・・・LoVAS trialの標準より少なく、減量より多い
- 再発例のため、減量レジメンよりも多い量で投与されている
Control
維持期(4〜24ヶ月):
- 経口アザチオプリン2mg/kg/日を24ヶ月間投与
- その後50%減量し、27ヶ月時点で中止
- アザチオプリン不耐例:eGFR>50mL/minの場合はメトトレキサート25mg/週(経口または皮下)、eGFR≤50mL/minの場合はミコフェノール酸モフェチル2g/日
グルココルチコイド:
- リツキシマブ群と同様
主要アウトカム
- ランダム化から疾患再発までの期間
- 再発の定義:BVAS/WGで少なくとも1項目の再出現または新規出現
- Major relapse:少なくとも1つのmajor BVAS/WG項目の発現を認めるもの
- Minor relapse:Major relapseの定義を満たさない疾患活動性の増加
副次アウトカム
- 維持期終了時または追跡期終了時に寛解を維持している割合
- major relapseまでの期間
- Combined Disease Assessment instrumentによる累積損傷の蓄積
- グルココルチコイドの累積曝露量
- SF-36による健康関連QOL
- 重篤な有害事象(SAE)の発生率
- 低ガンマグロブリン血症(血漿IgG<5g/Lと定義)
- 感染症
解析方法
- サンプルサイズ:少なくとも160名のランダム化を目標(58の再発イベント観察で、HR 0.42の対立仮説下で90%の検出力、5%有意水準)
- 24ヶ月時点で5%の脱落率、48ヶ月時点でリツキシマブ群75%、アザチオプリン群50%の無再発率を仮定
- 主要解析:層別因子(ANCA型、再発重症度、プレドニゾン導入レジメン)で調整したCox比例ハザードモデルによるintention-to-treat解析
- 閉検定手順を使用:まず全時点でHR=1の帰無仮説を検定し、5%水準で棄却された場合、24ヶ月まで と24ヶ月以降の2つの副次仮説を時間依存共変量を用用いて検定
- ハザード比と95%信頼区間を報告
- p値<5%を統計学的に有意とみなす
- Kaplan-Meier推定による24ヶ月および48ヶ月での無再発生存率と95%信頼区間を提示
- 低ガンマグロブリン血症の発症リスク因子について多変量解析を実施
Result
研究対象者
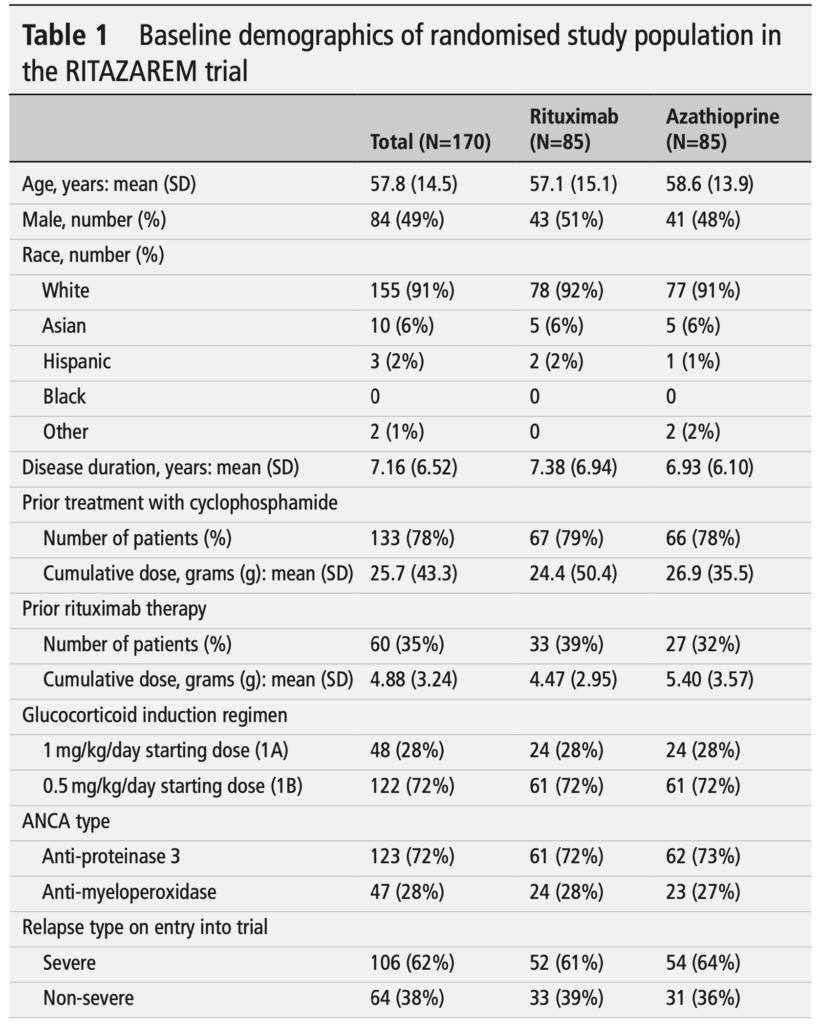
- 188名が登録され、リツキシマブとグルココルチコイドによる導入療法を受けた
- 170名(90%)が4ヶ月時点でランダム化され、リツキシマブ群85名、アザチオプリン群85名に割り付けられた
- 123名(72%)がPR3-ANCA陽性、47名(28%)がMPO-ANCA陽性
- 106名(62%)が少なくとも1つのmajor疾患活動性項目を有していた
- 48名(28%)が高用量グルココルチコイド導入レジメンを受けた
- 年齢:平均57.8歳(SD 14.5)
- 男性:84名(49%)
- 人種:白人155名(91%)、アジア人10名(6%)
- 疾患期間:平均7.16年(SD 6.52)
- シクロホスファミドによる前治療:133名(78%)
- リツキシマブによる前治療:60名(35%)
主要評価項目
維持期と追跡期を合わせた全体:
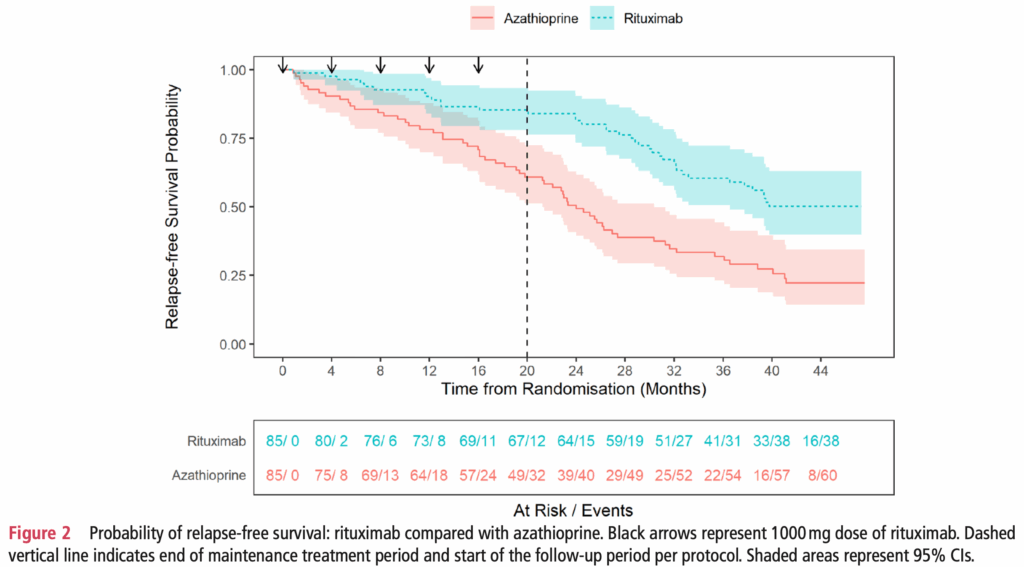
- リツキシマブ群がアザチオプリン群に対して再発予防において優れていた
- HR 0.41(95%CI 0.27~0.61、p<0.001)
- 維持期中のHR 0.35(95%CI 0.18~0.66、p=0.001)
- 追跡期中のHR 0.45(95%CI 0.26~0.78、p=0.004)
再発の発生:
- リツキシマブ群:85名中38名(45%)が52回の再発を経験(major 11回、minor 41回)
- アザチオプリン群:85名中60名(71%)が89回の再発を経験(major 28回、minor 61回)
維持期(4〜24ヶ月):
- リツキシマブ群:13/85(15%)が再発
- アザチオプリン群:32/85(38%)が再発
- 24ヶ月時点での無再発生存率:リツキシマブ群0.85(95%CI 0.78~0.93)、アザチオプリン群0.61(95%CI 0.51~0.73)
追跡期:
- リツキシマブ群:25名が33回の再発
- アザチオプリン群:28名が49回の再発
- リツキシマブ群で5名、アザチオプリン群で11名がmajor relapseを経験
- 48ヶ月時点での寛解維持率:リツキシマブ群0.50(95%CI 0.40~0.63)、アザチオプリン群0.22(95%CI 0.14~0.35)
Major relapseに関して:
- 全体のHR 0.36(95%CI 0.18~0.73、p=0.004)
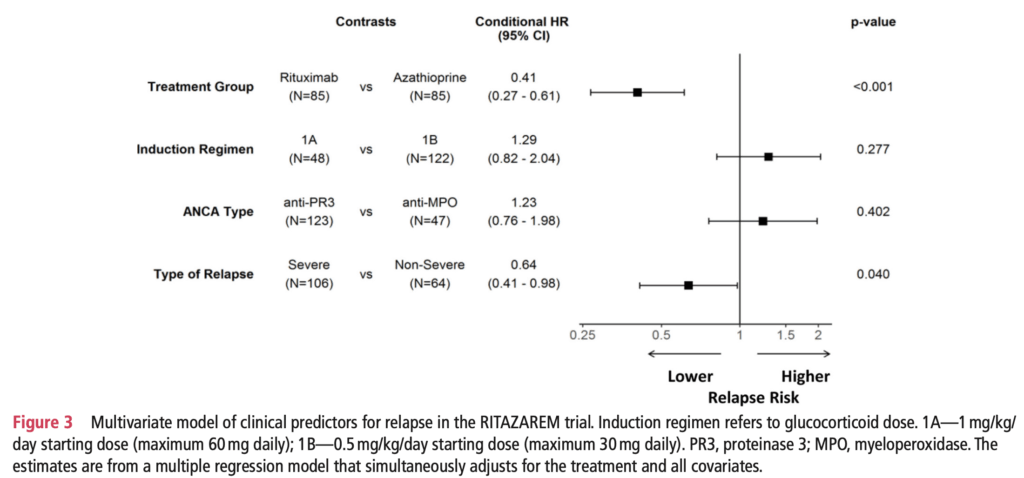
多変量回帰モデル:
- グルココルチコイド導入レジメン(高用量 vs 低用量):HR 1.29(95%CI 0.82~2.04、p=0.277)で再発リスクに影響なし
- ANCAサブタイプ(PR3-ANCA vs MPO-ANCA):HR 1.23(95%CI 0.76~1.98、p=0.402)で再発リスクに影響なし
- 試験参加時にmajor BVAS/WG項目の有無:HR 0.64(95%CI 0.41~0.98、p=0.040)
- 試験参加時に、major BVAS/WG項目を有してると再発リスクが低い
副次評価項目
治療遵守率:
- リツキシマブ群:81/85(95%)がプロトコールに準拠
- アザチオプリン群:78/85(92%)がプロトコールに準拠
- 追跡期中にリツキシマブ群の10/85(12%)、アザチオプリン群の15/85(18%)が免疫抑制療法を継続
グルココルチコイド曝露:
- 維持期中の累積プレドニゾロン量の中央値:両群とも2100mg(リツキシマブ群0〜5700mg、アザチオプリン群0〜9000mg)
- プロトコールからの逸脱:リツキシマブ群44名(52%)、アザチオプリン群57名(67%)が少なくとも1回の逸脱を報告
- 24ヶ月時点(プロトコールではグルココルチコイド中止時期)でもグルココルチコイドを継続:リツキシマブ群22/77(29%)、アザチオプリン群35/76(46%)
- 平均1日投与量:リツキシマブ群2.28mg(SD 5.45)、アザチオプリン群2.8mg(SD 5.5)
損傷評価:
- 両群間で損傷の蓄積に差はなし
- modified Combined Damage Assessment scoreの増加:
- 維持期中:リツキシマブ群0.571(SD 0.909)、アザチオプリン群0.533(SD 0.777)
- 試験全体:リツキシマブ群1.09(SD 1.18)、アザチオプリン群1.38(SD 1.65)
QOL指標:
- SF-36スコアのいずれの領域においても両群間で差は観察されず
- ランダム化時の身体的コンポーネントスコア中央値:リツキシマブ群37.25(範囲2.8〜61.6)、アザチオプリン群36.5(1.5〜58.1)
- 精神的コンポーネントスコア中央値:リツキシマブ群54.55(19.6〜67.7)、アザチオプリン群53.8(16.7〜72.6)
- スコアは維持期および追跡期を通じて安定
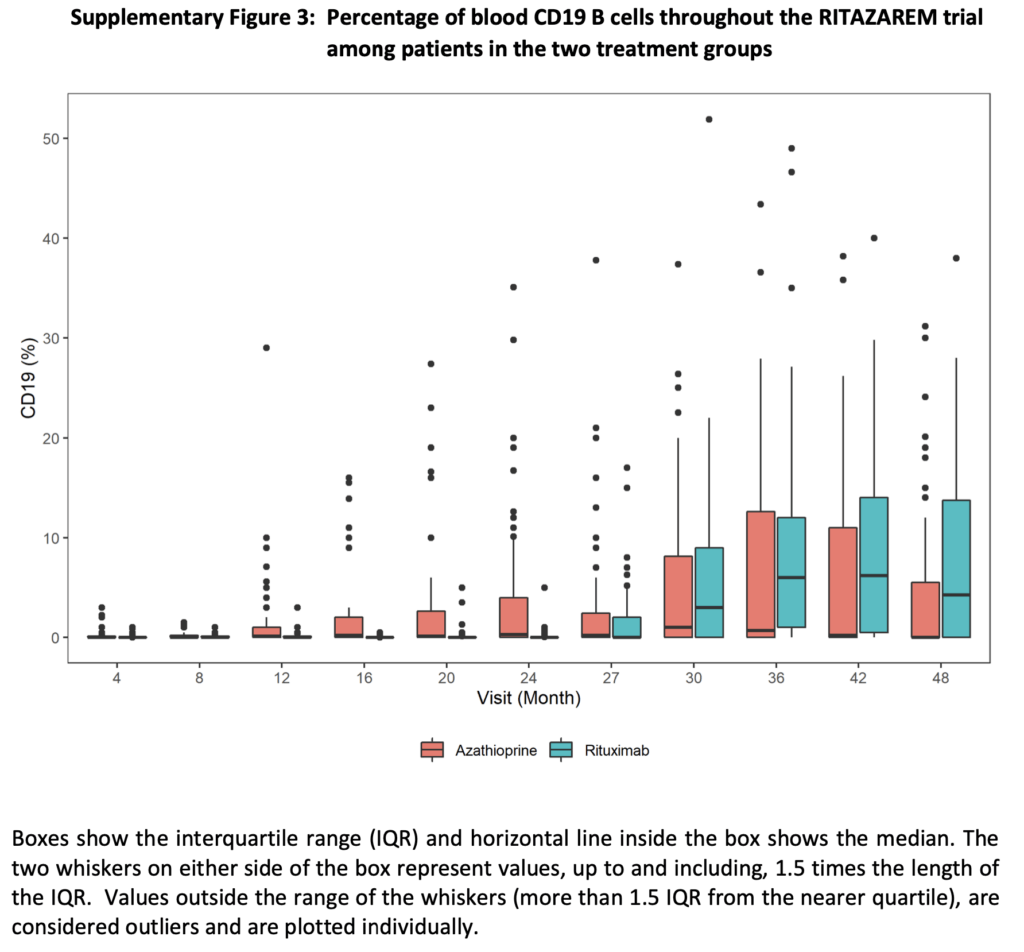
CD19陽性B細胞:
- 維持期中のCD19細胞数中央値:リツキシマブ群0×10⁹/L(0〜3)、アザチオプリン群0×10⁹/L(0〜5)
- CD19細胞の中央値パーセンテージ:リツキシマブ群は0(0〜5)のまま、アザチオプリン群は12ヶ月で0.1%(0〜29)、24ヶ月で0.3%(0〜35.1)に増加
- 追跡期中:アザチオプリン群でCD19細胞数が低かったが、これは再発治療にリツキシマブを使用したことによる交絡あり
安全性:
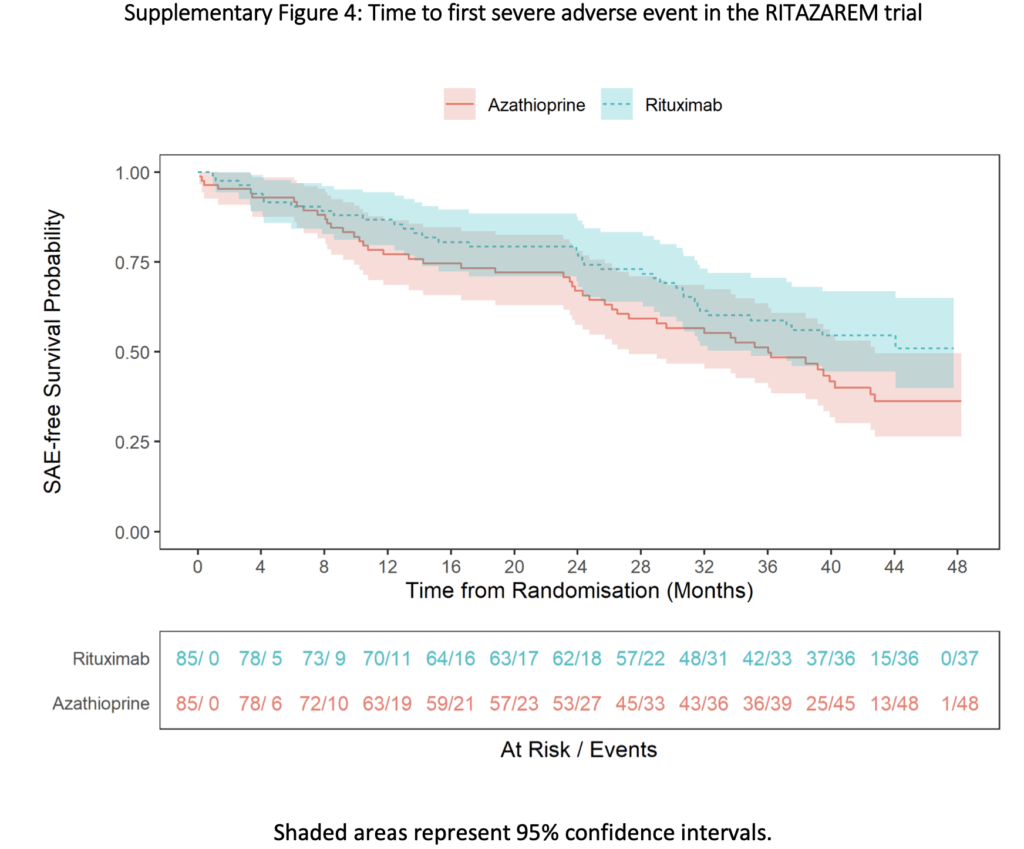
重篤な有害事象(SAE):
- リツキシマブ群:37名(44%)で69件
- アザチオプリン群:48名(56%)で105件
- 初回SAEまでの時間に差はなし
- 治療期間中に少なくとも1回のSAEを経験:リツキシマブ群19名(22%)、アザチオプリン群31名(36%)
重症感染症:
- リツキシマブ群:15名(18%)で19件
- アザチオプリン群:19名(22%)で27件
非重症感染症:
- リツキシマブ群:54名(64%)で197件
- アザチオプリン群:62名(73%)で207件
低ガンマグロブリン血症:
- 血漿IgG<5g/L:リツキシマブ群36名(42%)、アザチオプリン群26名(31%)
- 血漿IgG<3g/L:リツキシマブ群8名(9%)、アザチオプリン群6名(7%)
- 低ガンマグロブリン血症の発症と関連する因子:
- ベースライン血漿IgGレベルが低い:OR 0.52(95%CI 0.40~0.65、p<0.001)
- 高用量グルココルチコイド導入:OR 8.6(95%CI 3.02~27.58、p<0.001)
- リツキシマブ群の1名が低ガンマグロブリン血症と反復感染の治療のために静注免疫グロブリンを受けた
進行性多巣性白質脳症(PML):
- 1例が導入期後、維持期にランダム化されなかった患者で発生
新規悪性腫瘍:
- 11名が試験中に発症
- リツキシマブ群5名:皮膚(2)、前立腺(1)、膵臓(1)、食道(1)
- アザチオプリン群6名:皮膚(5)、膵臓(1)
死亡:
- 試験中に4名が死亡
- リツキシマブ群3名:感染症(1)、悪性腫瘍(1)、その他(1)
- アザチオプリン群1名:悪性腫瘍
Discussion
結果の解釈
- この国際ランダム化比較試験は、再発の既往を有するAAV患者において、リツキシマブとグルココルチコイドで寛解再導入後、リツキシマブがアザチオプリンより再発予防において優れていることを示した
- リツキシマブ群では平均グルココルチコイド曝露量も低かった
- MAINRITSAN 1試験と比較して本試験で高い再発率が認められたのは、患者集団と試験デザインの違いを反映している:
- RITAZAREMは再発時の患者を登録(その後の再発リスクが高い)
- 主要評価項目として major および minor relapse の両方を報告
- 追跡期間が(最大で)48ヶ月とより長い
- 維持期中の累積リツキシマブ投与量5000mgはMAINRITSANの2倍であったが、治療中にリツキシマブ群の15%で再発が認められ、高用量リツキシマブに対して難治性の疾患を有する患者のサブセットが同定された
- 登録時にmajor BVAS/WG項目を有していた患者での再発リスクが低いという所見は、より重度の腎血管炎での再発リスクが低いという以前の観察と一致している
- Arthritis Rheum 2012;64:542–8.
- 治療中止後、両群で再発が発生し、高用量であってもリツキシマブの効果が治療期間を超えて持続しないことが示された
Limitation
- 非盲検試験薬の使用であったが、盲検化された判定委員会による評価項目の潜在的影響は相殺された
- グルココルチコイドの長期使用が採用されたのは、再発リスクへの既知の影響と、再発リスクが高い集団を含むことによるが、その価値は評価できず、再発性疾患を有する患者におけるグルココルチコイドの最小化の必要性は残る
- 以前の免疫抑制薬曝露が結果を潜在的に交絡させた可能性があるが、曝露は治療群間で同等であった
- 具体的な臓器病変への腎病変や肺病変の割合は不明
- ステロイドパルスの実施割合、パルスの有無・量による結果への影響が記載されていない
臨床への影響
- RITAZAREM試験の結果は、リツキシマブで寛解導入した再発性AAV患者において、反復投与リツキシマブがアザチオプリンより再発予防に効果的であることを示している
- これらのデータは、寛解導入における再発性疾患に対するリツキシマブの有効性に関する以前の報告を拡張し、維持療法の標準治療としてのリツキシマブの位置を確認している
- 結果はAAVにおけるグルココルチコイド曝露のさらなる削減を促すべきである
- 先行研究であるMAINRITSAN1よりも、高用量のリツキシマブレジメンにもかかわらず再発が発生したこと、リツキシマブ中止後の再発リスクの増加、および関連する安全性リスクは、AAVのための新しい治療薬の必要性を示している
- リツキシマブに関する新しい安全性は認められず、感染症と低ガンマグロブリン血症はこの患者集団で依然として一般的な問題である
- AAVの将来の治療戦略は、長期治療による有害事象のリスクとバランスを取った再発リスクを考慮に入れた、より個別化されたアプローチが必要となる可能性がある
よい点
- 再発性AAV患者を対象とした臨床試験に登録された最大のコホートである
- 中央ランダム化を使用している
- 4大陸29施設から患者を募集し、施設または地域バイアスを最小化している
- 試験薬中止後の長期追跡期間があり、介入の長期効果や安全性の問題を検出することを目的とした設計である
- 盲検化された判定委員会による評価項目の判定を行っている



コメント