- この論文のまとめ
- 一言で:(ループス腎炎を除く)全身性エリテマトーデス患者に、標準治療に加えてベリムマブを投与することで、SLEの疾患活動性を改善することができる。
- 背景と目的:全身性エリテマトーデスの病態にB細胞が、その生存にBLySが重症であることが分かっており、これに結合するベリムマブはSLEにおいて重要な役割を果たす可能性がある。疾患活動性のあるSLE患者に対して標準治療に加えてベリムマブを投与することで疾患活動性を抑えられるかを評価した。
- 結果:52週時点において、ベリムマブ群の方がSRI達成率が高かった。またステロイド減量効果や再燃抑制効果を認めた。
- 実臨床での使いどころ・注意点:標準治療に加えてベリムマブを投与することで、全身性エリテマトーデスの疾患活動性をより抑えることができるかもしれない。ただ本試験に含まれる患者層に注意が必要である
- ANA・dsDNAIgGのいずれかが陽性
- 疾患活動性はあるが、30日間治療が変更されておらず安定している
- 重症・活動性ループス腎炎、NPSLEは除外されている
Efficacy and safety of belimumab in patients with active systemic lupus erythematosus: a randomised, placebo-controlled, phase 3 trial
Sandra V Navarra, Renato M Guzmán, Alberto E Gallacher, Stephen Hall, Roger A Levy, Renato E Jimenez, Edmund K-M Li, Mathew Thomas, Ho-Youn Kim, Manuel G León, Coman Tanasescu, Eugeny Nasonov, Joung-Liang Lan, Lilia Pineda, Z John Zhong, William Freimuth, Michelle A Petri, for the BLISS-52 Study Group
Lancet 2011; 377: 721–31
Introduction
背景
- 全身性エリテマトーデス(SLE)は、罹患率、死亡率の増加、生活の質の低下をもたらす多系統自己免疫疾患である
- B細胞の生存に重要なサイトカインであるBLyS(B-lymphocyte stimulator)が、SLEおよび他の自己免疫疾患患者で過剰発現している
- SLE患者において、BLyS濃度は疾患活動性およびanti-dsDNA抗体価の変化と関連している
わかっていること
- Belimumab(Benlysta)は、可溶性ヒトBLySに結合してその生物学的活性を阻害する完全ヒトIgG1-λモノクローナル抗体である
- BelimumabはSLE患者においてCD20+ B細胞および短寿命形質細胞(short-lived plasma cells)の数、およびanti-dsDNA抗体価を選択的に減少させる
- Phase 2試験では、belimumabは生物学的に活性で忍容性が良好であった
- Phase 2試験の非盲検延長試験(4年間)では、有害事象の頻度が減少し、血清陽性患者では疾患活動性の持続的改善と再燃の減少が認められた
- Arthritis Rheum 2009; 61: 1168–78.
わかっていないこと
- Phase 2試験では主要評価項目(24週時点でのSELENA-SLEDAI減少と52週間での初回再燃までの期間延長)は達成されなかった
- SLEの新規治療開発は困難であり、50年以上にわたりSLEに特異的に承認された薬剤がない
今回の研究目的
血清陽性全身性エリテマトーデス患者における標準治療とbelimumabの併用療法の有効性、安全性、忍容性を評価すること
Method
ラテンアメリカ(アルゼンチン、ブラジル、チリ、コロンビア、ペルー)、アジア太平洋(オーストラリア、香港、インド、韓国、フィリピン、台湾)、東欧(ルーマニア、ロシア)の13カ国90施設
研究デザイン
多施設共同、無作為化、プラセボ対照、二重盲検、第3相試験
Inclusion criteria
- 18歳以上
- 1997年American College of Rheumatology基準を満たすSLE患者
- 抗核抗体陽性(力価≥1:80)またはanti-dsDNA抗体陽性(≥30 IU/mL)
- 活動性あり(スクリーニング時のSELENA-SLEDAIスコア ≥ 6)
- 初回投与前に、少なくとも30日間、プレドニゾン(0-40 mg/日)、非ステロイド性抗炎症薬、抗マラリア薬、免疫抑制薬の固定用量で治療が安定していること
- 免疫抑制薬は、MMF・AZA・MTXを指す
Exclusion criteria
- 重症活動性ループス腎炎またはCNSループス
- 妊娠
- B細胞を標的とした薬剤(リツキシマブを含む)による過去の治療
- 登録6ヶ月以内の静脈内シクロホスファミド投与
- 3ヶ月以内の静脈内免疫グロブリンまたはプレドニゾン(>100 mg/日)投与
- 本文中に重症活動性ループス腎炎の定義は記載されていない
- ループス腎炎に対する解釈は、のちのBLISS-LN trialで確認されることになる
介入
- 標準治療に加えて、Belimumab 1 mg/kgまたは10 mg/kgを、0、14、28日目、その後48週まで28日ごとに1時間の静脈内注入で投与
Control
- プラセボを同様のスケジュールで静脈内注入し、標準治療を併用
主要アウトカム
52週時点でのSystemic Lupus Erythematosus Responder Index(SRI)の達成率
- SRI基準:ベースラインと比較して52週時点で以下を満たす
- SELENA-SLEDAIスコアが少なくとも4ポイント減少
- 新規BILAG A臓器:ドメインスコアなし
- 新規BILAG B臓器:ドメインスコアが1つ以内
- PGA(Physician’s Global Assessment)スコアの悪化なし(<0.3の増加)
副次アウトカム
主要副次評価項目:
- 52週時点でベースラインからSELENA-SLEDAIスコアが少なくとも4ポイント減少した患者の割合
- 24週時点でのPGAスコアの変化
- 24週時点でのSF-36の変化
- 40-52週の間にベースラインからプレドニゾン用量が少なくとも25%減少し7.5 mg/日以下になった患者の割合
その他の副次評価項目:
- 経時的なSRIの3つの構成要素の評価
- 52週間のSFI、BILAGで測定したSLE再燃の発生率と発生までの時間
- ステロイド減量効果
- ベースラインからのバイオマーカー変化
安全性評価
解析方法
- 修正intention-to-treat集団(投与を受けた全ての無作為化された患者)で分析
- 主要有効性評価項目は、ベースライン無作為化層別因子で調整したロジスティック回帰モデルで評価
- サンプルサイズ:810人(各群270人)で、5%有意水準で90%検出力を持つよう計算
- 段階的手順を使用してI型エラーを制御(両側α=0.05)
- 二値有効性変数はロジスティック回帰モデル、連続変数は共分散分析モデル、time-to-flare変数はCox比例ハザードモデルで分析
- すべての分析はベースライン無作為化因子で調整
Result
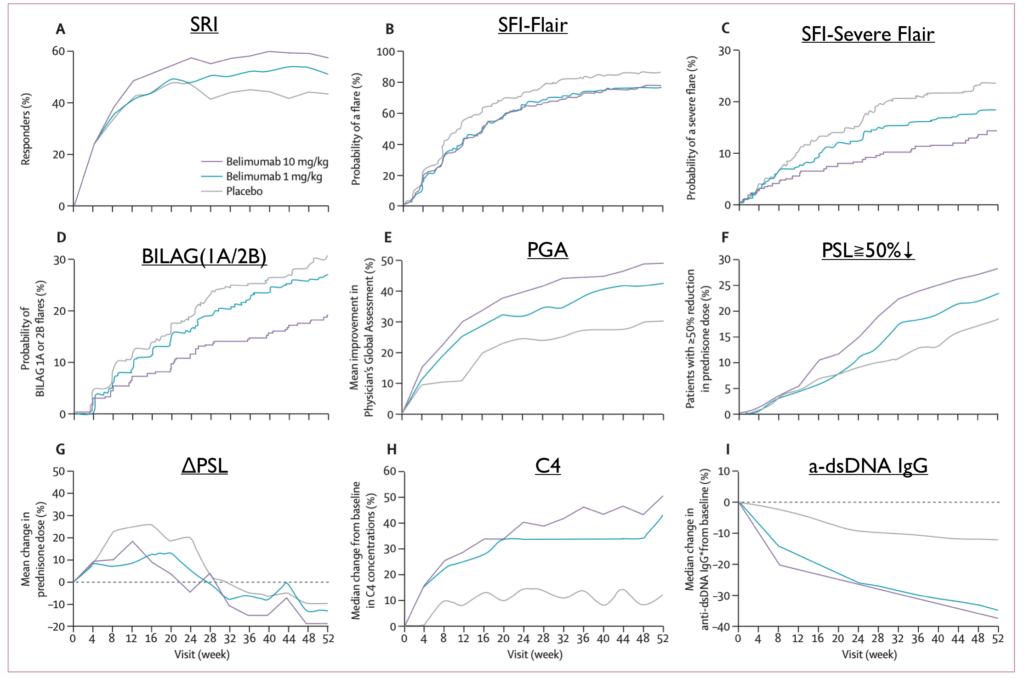
研究対象者
- 2007年5月8日から2008年4月14日までに867人のSLE患者を無作為化
- Belimumab 1 mg/kg群:289人
- Belimumab 10 mg/kg群:290人
- プラセボ群:288人
- 2人は治療を受けずに除外され、修正intention-to-treat集団は865人
- 完了者:
- Belimumab 1 mg/kg群:240人(48人中止)
- Belimumab 10 mg/kg群:241人(49人中止)
- プラセボ群:226人(61人中止)
- 筆者注
- 臓器障害の割合
- SELENA-SLEDAIでは
- 免疫学的(85%程度)>皮膚(80%程度)>筋骨格(60%程度)>>腎臓(20%)>血液・血管(6%程度)となっている
- BILAGでは
- 粘膜(60%程度)>筋骨格(50%程度)>>血液(20%程度)>腎(15%程度)
- SELENA-SLEDAIでは
- 治療介入
- グルココルチコイドは平均13mg/day程度で使用している
- 免疫抑制薬の使用が40%程度(つまり半分以上がHCQ+PSL、HCQ・PSL単剤)
- 疾患活動性
- SELENA-SLEDAI 10点程度。
- 臓器障害の割合
主要評価項目
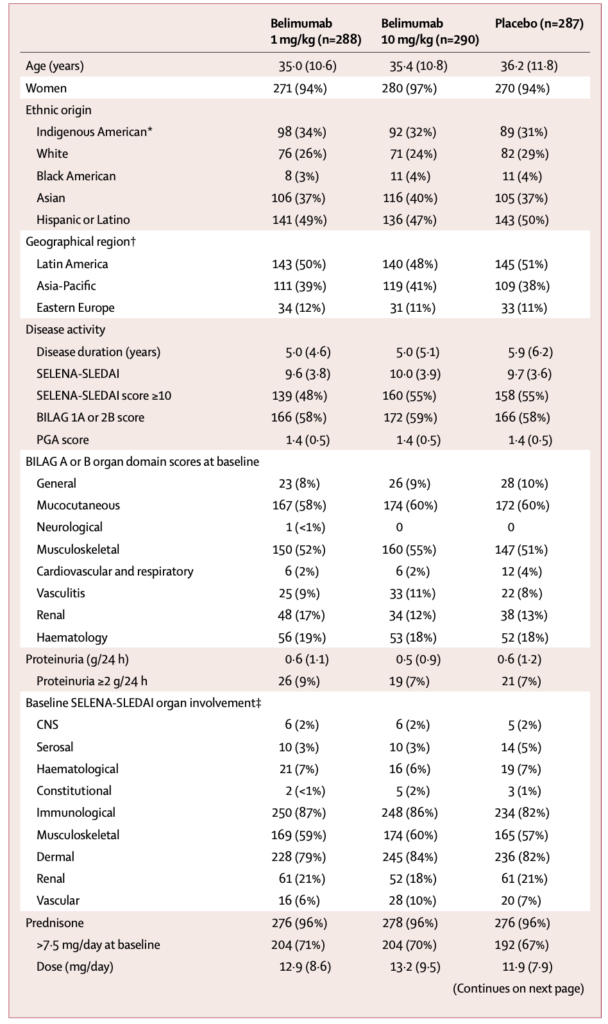
52週時点でのSRI達成率:

- Belimumab 1 mg/kg群:148人(51%)、オッズ比1.55(95% CI 1.10-2.19)、p=0.0129
- Belimumab 10 mg/kg群:167人(58%)、オッズ比1.83(95% CI 1.30-2.59)、p=0.0006
- プラセボ群:125人(44%)
副次評価項目
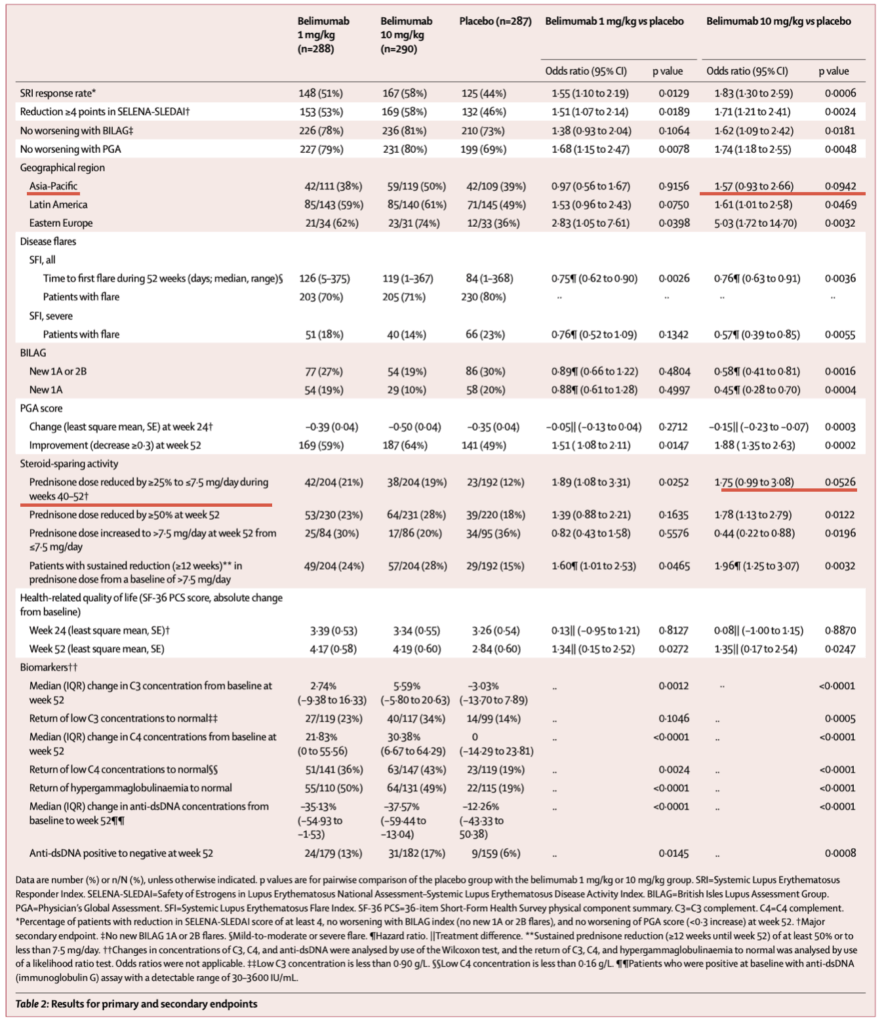
SELENA-SLEDAIスコア≥4ポイント減少(52週時点):
- Belimumab 1 mg/kg群:153人(53%)、オッズ比1.51(95% CI 1.07-2.14)、p=0.0189
- Belimumab 10 mg/kg群:169人(58%)、オッズ比1.71(95% CI 1.21-2.41)、p=0.0024
- プラセボ群:132人(46%)
BILAGでの悪化なし(新規1Aまたは2B以内、52週時点):
- Belimumab 1 mg/kg群:226人(78%)、オッズ比1.38(95% CI 0.93-2.04)、p=0.1064
- Belimumab 10 mg/kg群:236人(81%)、オッズ比1.62(95% CI 1.09-2.42)、p=0.0181
- プラセボ群:210人(73%)
PGAスコアの悪化なし(52週時点):
- Belimumab 1 mg/kg群:227人(79%)、オッズ比1.68(95% CI 1.15-2.47)、p=0.0078
- Belimumab 10 mg/kg群:231人(80%)、オッズ比1.74(95% CI 1.18-2.55)、p=0.0048
- プラセボ群:199人(69%)
再燃(52週間):
- SFI全再燃までの期間中央値:Belimumab 1 mg/kg 126日、10 mg/kg 119日、プラセボ 84日
- SFI重症再燃:Belimumab 10 mg/kg群でプラセボと比較してハザード比0.57(95% CI 0.39-0.85)、p=0.0055
- BILAG新規1Aまたは2B:Belimumab 10 mg/kg群でハザード比0.58(95% CI 0.41-0.81)、p=0.0016
地域別のSRI反応率(52週時点):
- アジア太平洋・ラテンアメリカ・東欧中心の患者層
- 東欧でbelimumabの効果が数値的にはアジア太平洋やラテンアメリカより大きかったが、3地域間の差は有意ではなかった(p=0.18、全治療と全地域の治療×地域の交互作用)
52週時点でのPGA改善(≥0.3の減少):
- Belimumab 1 mg/kg:169人(59%)、オッズ比1.51(95% CI 1.08-2.11)、p=0.0147
- Belimumab 10 mg/kg:187人(64%)、オッズ比1.88(95% CI 1.35-2.63)、p=0.0002
- プラセボ:141人(49%)
ステロイド減量効果:
- 40-52週にプレドニゾン用量 ≥ 25%減少 + ≤ 7.5 mg/日:
- Belimumab 1 mg/kg 21%、10 mg/kg 19%、プラセボ 12%(1 mg/kgでp=0.0252)
- 52週時点で ≥ 50%減少:
- Belimumab 10 mg/kg 28%、プラセボ 18%(p=0.0122)
- ≤7.5 mg/日から>7.5 mg/日への増量(52週時点):
- Belimumab 10 mg/kg:17/86(20%)、プラセボ:34/95(36%)オッズ比0.44(95% CI 0.22-0.88)、p=0.0196
- >7.5 mg/日からの持続的減少(≥12週間):
- Belimumab 1 mg/kg:49/204(24%)、ハザード比1.60(95% CI 1.01-2.53)、p=0.0465
- Belimumab 10 mg/kg:57/204(28%)、ハザード比1.96(95% CI 1.25-3.07)、p=0.0032
- プラセボ:29/192(15%)
健康関連QOL(SF-36 PCS):
- 24週時点:3群間で有意差なし
- 52週時点:Belimumab両群でプラセボより有意な改善(治療差約1.3-1.4、p=0.0272および0.0247)
バイオマーカーの変化:
- C3濃度:52週時点でbelimumab両群でプラセボより有意な増加
- C4濃度:52週時点でbelimumab両群でプラセボより有意な増加
- Anti-dsDNA抗体:52週時点でbelimumab両群でプラセボより有意な減少
- 高ガンマグロブリン血症の正常化:Belimumab両群でプラセボより有意
- 低C3濃度の正常化:
- Belimumab 1 mg/kg:27/119(23%)、p=0.1046
- Belimumab 10 mg/kg:40/117(34%)、p=0.0005
- プラセボ:14/99(14%)
- 低C4濃度の正常化:
- Belimumab 1 mg/kg:51/141(36%)、p=0.0024
- Belimumab 10 mg/kg:63/147(43%)、p<0.0001
- プラセボ:23/119(19%)
- 高ガンマグロブリン血症の正常化:
- Belimumab 1 mg/kg:55/110(50%)、p<0.0001
- Belimumab 10 mg/kg:64/131(49%)、p<0.0001
- プラセボ:22/115(19%)
- Anti-dsDNA陽性から陰性への転換(52週時点):
- Belimumab 1 mg/kg:24/179(13%)、p=0.0145
- Belimumab 10 mg/kg:31/182(17%)、p=0.0008
- プラセボ:9/159(6%)
安全性
- 有害事象、重篤または重度の有害事象(感染症含む)、検査値異常、有害事象による中止の発生は3群間で同様
- 感染症
- すべての群で重篤感染症の90%以上が入院に至った。3群間で感染症の種類に違いは認められなかった
- 投与部位反応
- 注入反応は群間で同様だった。
- 重度の過敏症または注入反応の発生率は、belimumab群でプラセボ群より数値的に高かった
- アナフィラキシー反応
- 3例のアナフィラキシー反応が報告された(belimumab 1 mg/kg群で2例、10 mg/kg群で1例)、すべて初回投与後
- 2例は重度で、血管浮腫を伴い、プレドニゾンまたは抗ヒスタミン薬で改善
- 1例はエピネフリンで治療
- 死亡
- 試験中に9人が死亡
- Belimumab群で3例が感染症による死亡
- プラセボ群で1例が敗血症に続発した心停止で死亡
- 悪性腫瘍
- 報告なし
- 妊娠転帰
- 転帰が判明している17例の妊娠のうち、自然流産または死産の発生率は3群間で同様
- 2例の死産が子癇発症後に報告:プラセボ群で1例、belimumab 10 mg/kg群で1例

Discussion
結果の解釈
- 結果
- Belimumabと標準治療の併用は、52週時点でプラセボと標準治療よりSRIで評価した反応率が有意に高かった
- 用量依存性効果が認められ、belimumab 10 mg/kgはSRIの3つの構成要素すべてでプラセボより有意に良好な反応を示した
- Belimumabによる臨床的改善の開始は16週という早期に認められた
- 両belimumab群でプラセボ群と比較して初回再燃までの期間中央値の延長した
- Phase2 trialでは、主要評価項目であった「24週時点でのSELENA-SLEDAI減少」と「52週間での初回フレアまでの期間延長」は達成されなかった。
- 解釈
- Belimumabは迅速、選択的、持続的な血清学的活性の改善をもたらした
- 標準治療にベリムマブを併用することで再燃リスクが減少できる可能性がある
- Belimumabはステロイド使用量を減量させる効果がある
- Phase2 trialでは達成できなかったが、本試験で主要評価項目を達成した理由
- Phase2でも、血清陽性SLE患者(全体の71.5%)では、belimumabが疾患活動性を減少させ安定化させたことから、本試験においては、ANA≥1:80またはanti-dsDNA≥30 IU/mLを必須とした点
- 主要評価項目をSRIという複合評価項目とした。
- 患者層を、疾患活動性はあるが、30日間治療は安定している患者に限定した
Limitation
- 安全性の評価は、より多くの患者を52週以上治療するまで除外できない
- BLISS-52試験デザインでは、特定の標準治療との直接比較や、試験から除外された患者サブグループ(小児、重症活動性ループス腎炎、CNS血管炎など)の評価ができなかった
臨床への影響
- Belimumabは、SLEに特異的に承認される最初の標的生物学的治療薬となる可能性がある
- 再燃の減少は、長期的な障害、罹患率、死亡率を減少させ、患者アウトカムの改善、疾患コストの削減、健康関連QOLの改善につながる可能性がある
- ステロイド用量の削減は、副作用や長期的障害の予防、感染リスクの低下、SLE患者の全般的健康の改善にとって臨床的に重要である
この論文のいい点
- 大規模な多施設国際共同試験で、広範な地域(ラテンアメリカ、アジア太平洋、東欧)からの患者を含んでいる
- 厳密な二重盲検、プラセボ対照、無作為化デザインを採用している
- Phase 2試験からの学習を活かし、血清陽性患者の選択、SRIを主要評価項目として使用、疾患活動性評価の厳格なトレーニングなど、研究デザインを改善している
- 主要評価項目だけでなく、多数の副次評価項目(疾患活動性、再燃、QOL、バイオマーカー、ステロイド節約効果など)を包括的に評価している
- 安全性データを詳細に報告している
- 結果が一貫しており、複数の評価指標で有効性が示されている
この論文の悪い点
- 52週という比較的短い観察期間であり、長期的な有効性と安全性は不明
- 重症ループス腎炎やCNSループスの患者が除外されており、これらの患者への有効性は評価されていない
- 小児患者が含まれていない
- まれな有害事象については、より大規模で長期の研究が必要
- プラセボ群の中止率(21%)がbelimumab群(17%)よりやや高く、これが結果に影響を与えた可能性がある
- アジア人においては、主要評価項目に有意差がついていないが、主要評価項目以外での評価はなされていない
- SLEの臓器障害ごとの転帰については記載されていない



コメント