血漿交換は、主に血漿中の物質を取り除くために行われる治療です。
そのため、血漿中に存在する、本来取り除きたくないものまで除かれてしまいます。(免疫グロブリン・凝固因子・アルブミンなどが主な問題)
血漿中には薬剤も含まれており、これを考慮しないと、投与した薬剤がすべて交換されてしまいます。
血漿交換を使用するタイミングは、主に膠原病(皮膚筋炎など)・神経(ギラン・バレー症候群など)が大半と考えられ、これらの病気に併用する薬剤も、自ずと同じようなものになることが多いです。
従って、これらの病気に頻用される薬剤を血漿交換と併用するとどれくらい除去されるかを把握しておくことは、非常に重要です。
血漿交換による薬剤の除去率をまとめた論文を紹介します。
Neurocrit Care (2021) 34:301–311
MEDLINE(1946年~2019年4月)、PubMed(1973年~2019年2月)、EMBASE(1974年~2019年4月)のデータベースで文献を検索した。
125件の研究が含まれたが、報告の約3分の1は治療中のPEによる薬物除去に関するもので、約3分の2は薬物過量投与時のPEの使用に関するもの。
薬物過量投与の場合には、通常の使用と薬物動態が異なる可能性があることに注意が必要。
PEによる薬物除去の程度はどのように決まるか
おもに、分布容積(Vd)と血漿蛋白結合率(fb)によって決定します。
分布容積(Vd)とは
「薬物を体内に投与した時の血中濃度と、同じ濃度に希釈するための血液容積」のこと。
このときの薬物血中濃度は、遊離している薬物+タンパクに結合している薬物のすべてを含みます。
内服すると、40%が組織に、40%が組織液に、20%が血液に分布する薬剤を考えます。(一般的には、例えば60kgの人では、水分量は60%で、36L。細胞内液は24L、細胞外液は12L。細胞外液のうち、8Lが細胞外液、4Lが血液になります。)

このとき、薬物の血中濃度は、分布した薬剤を血液容積で割って計算されます。従って、もともと投与する薬剤料を同じ濃度に希釈する血液容積は、血液中に分布する薬物量の逆数になるはずです。
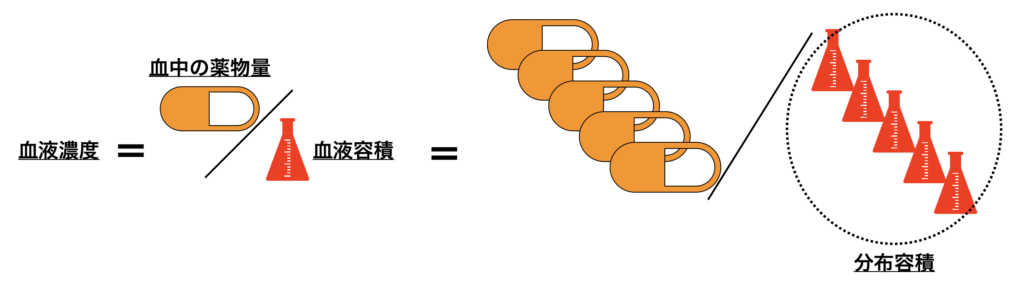
従って、今回のVdは5×血液容積となります。
Vdは、定義上は「血液容積」のため、単位はmLですが、一般的には血液容積÷体重=mL/kgで表します。
成人においては、理論上は体重あたりの血液量は一定のはずなので体重で割ることで変化は起きませんが、体格差がある場合にこれを補正することができます。
具体的なVdの値
Vd 〜200mL/kg ・・・分布容積小さい=多くは細胞外液に分布
60kgでいえば、12,000mL=12L。前述の通り、60kgあたりの人の細胞外液は12Lであることから、組織に一切分布せず、組織液・血液に均等に分布する場合のVdはこのような値になります。
Vd 〜600mL/kg ・・・体全体に分布
60kgでいえば、36L。水分量全体にあたり、体の水分量全体に分布していることを示します。(実際に均等に分布しているわけではなく、血液中にはそう解釈される量があるのみで、組織液と細胞内に均等に存在することを表しません。)
Vd 〜1000mL/kg ・・・組織移行性が高い=血液中に分布しない
60kgでいえば、60L。実際の体の水分量より多い量で、血液中にはほとんど分布しないことが分かります。多くは細胞内など組織中に多く存在します。
血漿交換とVdの関係
血漿交換は血液にしか介入できません。そのため、血漿交換によって影響を受けるかどうかは、血液中の薬物中の濃度に依存します。
- 低いVd(<0.2-0.3 L/kg)を示す薬物は、PEによる除去を受けやすい
- Vdが高い(>1/kg)の場合は、組織中の薬剤がPE後に血液中に再分布して、リバウンド効果を示す可能性がある
- 実際に報告されているのは
- バンコマイシン・フェニトイン・カルバマゼピン ・・・Vd高い
- ゲンタマイシン・トブラマイシン
タンパク結合率(Fb)とは
薬物の多くは,血漿中でアルブミンやα1-酸性糖タンパクなどのタンパク質へ結合しています。
アルブミンは脂溶性の高い酸性化合物,α1-酸性糖タンパクは塩基性化合物に対し高い親和性を示します。
蛋白質に結合した薬物は、血液から移動することができないため、薬効・毒性がなく、代謝を受けることもありません。よって血液中に保存されているといってもよいかもしれません。逆に、実際に効果や副作用、代謝を受けるのは遊離型の薬剤です。
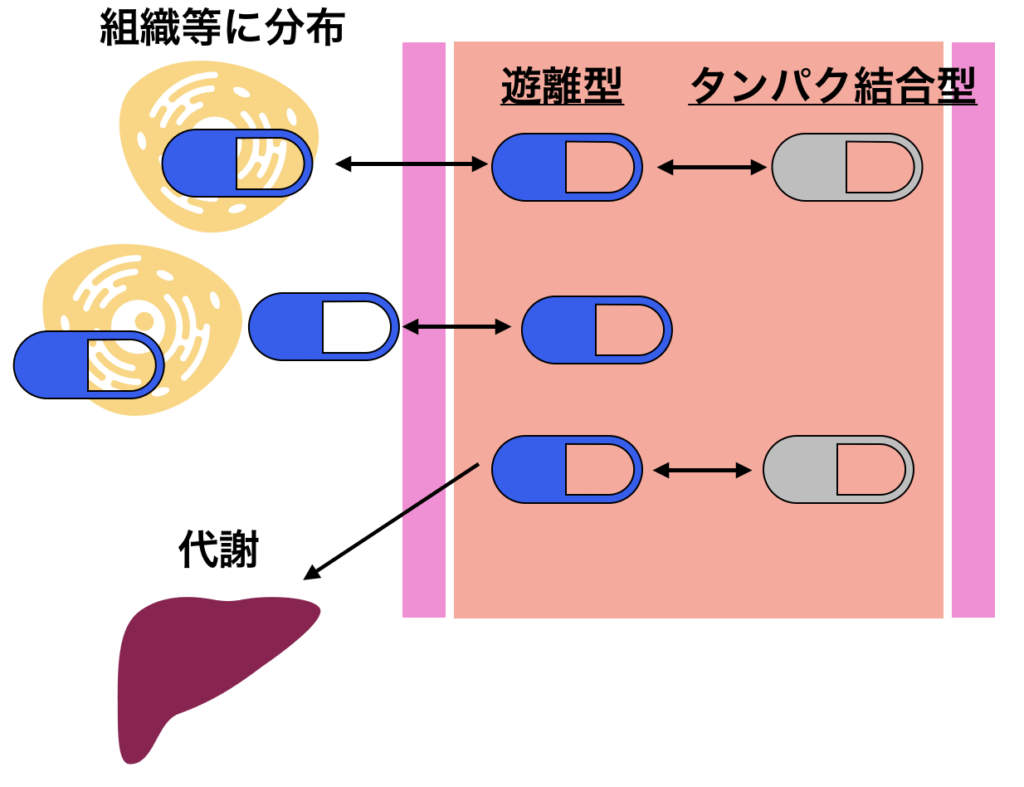
従って、タンパク結合率は実際の薬物の効果や副作用、代謝を把握する上で非常に重要です。以下の様に様々な要因によって変化します。
- 患者の病態
- ネフローゼ等による低アルブミン血症では遊離型が増加する
- α1酸性糖タンパク濃度は外傷・炎症・心筋梗塞で上昇して、遊離型が低下する
- アルブミンに結合する薬物以外の物質の増加(ビリルビン・尿毒症性毒素など)によって、薬物のアルブミン結合率が低下して、遊離型が増加する
- アルブミンへの結合部位は主に3カ所あり、薬剤によって結合する部位が異なるため、必ずしも増加するわけはない
- 薬物相互作用による変動
- 結合するタンパクが併用薬と競合することで、それぞれの遊離型が増加する
- 具体的には、アスピリン・ST合剤などはアルブミンへの結合率が高いことに加えて、治療域での血漿中濃度が高いため相互作用を生じやすい
- これらとワルファリンを併用することは、両者の血漿中薬物濃度を増加させるため注意が必要である
- PEとの関連
- タンパク結合率が高いほど、PEで除去されやすくなります。
- PEにおけるアルブミンやFFPの補充によって影響をうけます
- PEでタンパク補充を行わない場合には、PE後に薬物の遊離分画が増加する可能性があります(本邦においてはAlb補充等を行わないことは少ないと思いますが)
- トラフ(薬物血中濃度)
- バンコマイシン、抗てんかん薬、ボリコナゾール、カルシニューリン阻害剤などさまざまな薬剤で測定することができる薬物血中濃度ですが、これは血中の遊離型+タンパク結合型の濃度を反映しています
- そのため厳密に薬理作用を反映しているわけではないことに注意が必要です。
日薬理誌(Folia Pharmacol. Jpn.)134,78~81(2009)を参考に記載
薬物の分布による影響
血液中以外にも分布する薬剤の場合、投与してから血液中以外に分布するまでに時間を要します。
その時間によって、投与直後の多くが血液中に分布するフェーズにおいては、PEの効果は当然大きくなり、投与してから血液中以外に多くが分布している時期では(Vdが低い場合)、PEの効果は低くなります。
PE実施患者への薬物動態の具体的な解釈
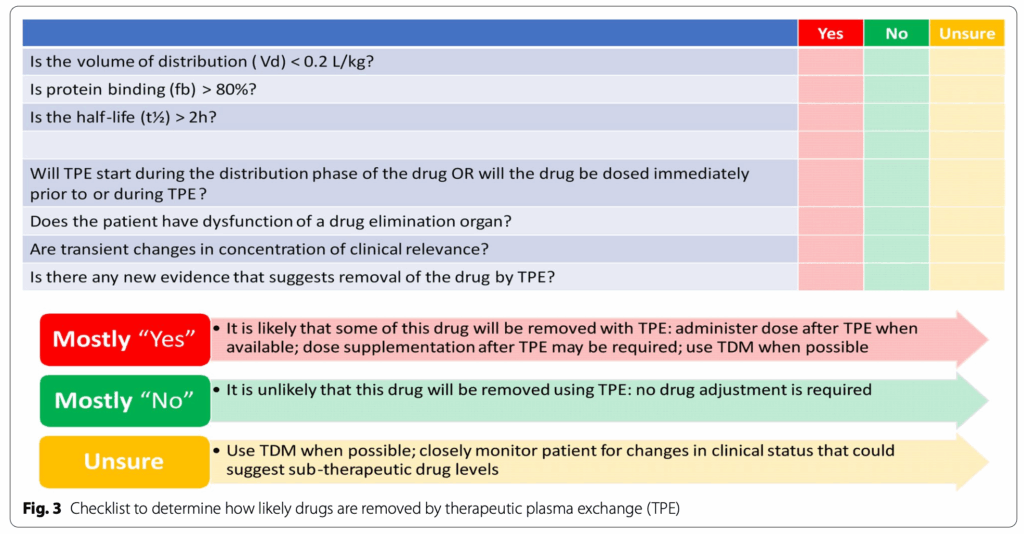
以上を踏まえて、PEを行う患者の薬物管理に関して、以下の様にアプローチしましょう
薬剤ごとのエビデンス
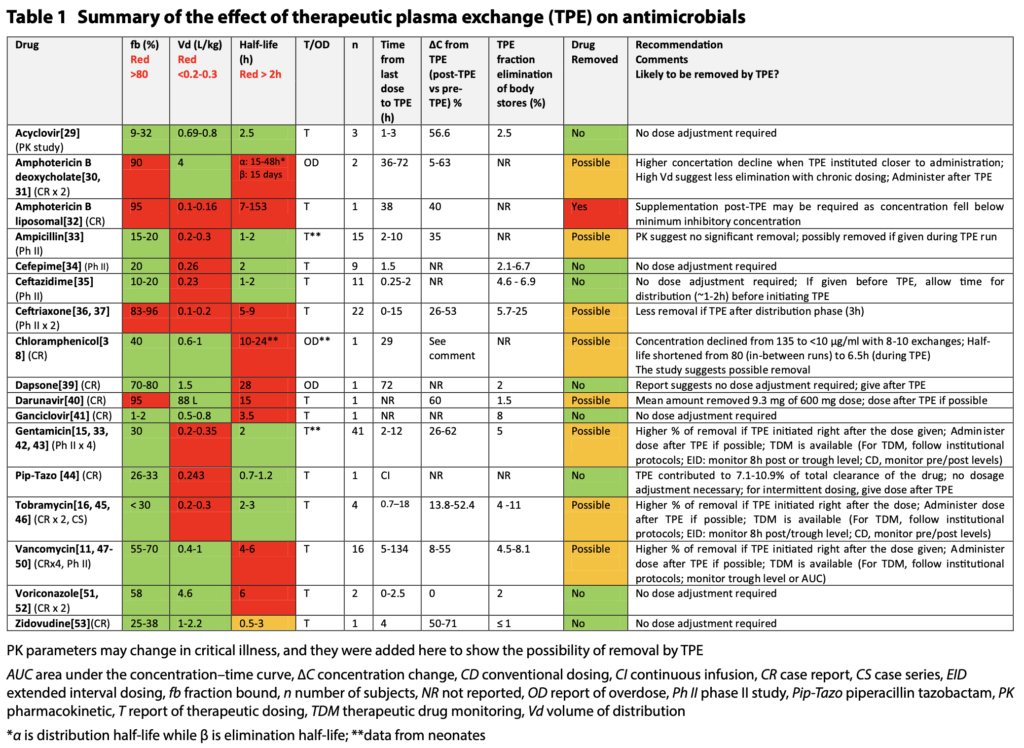
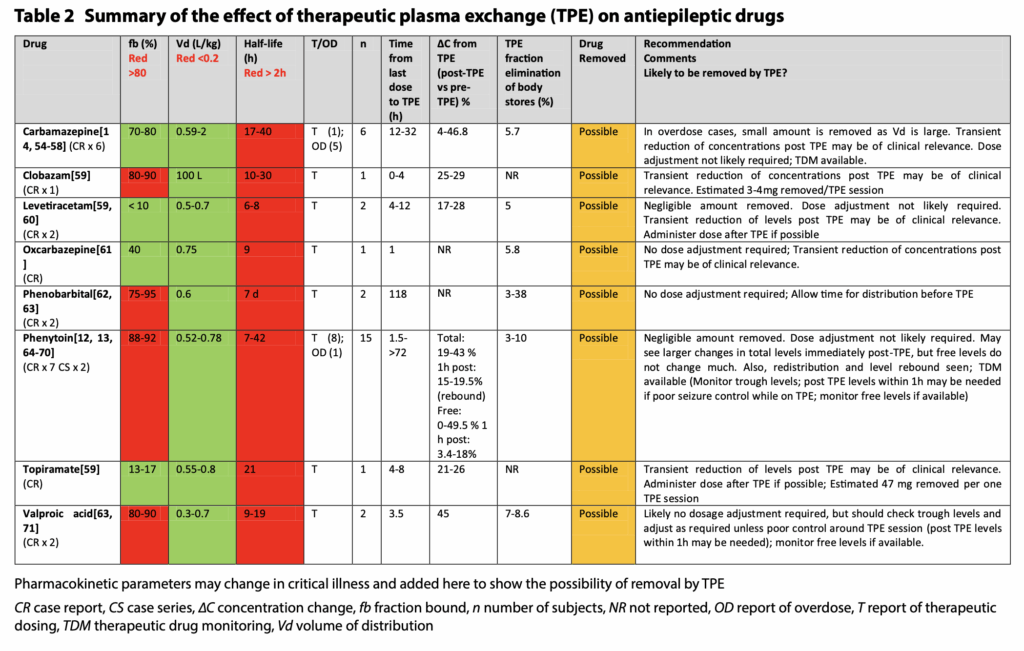
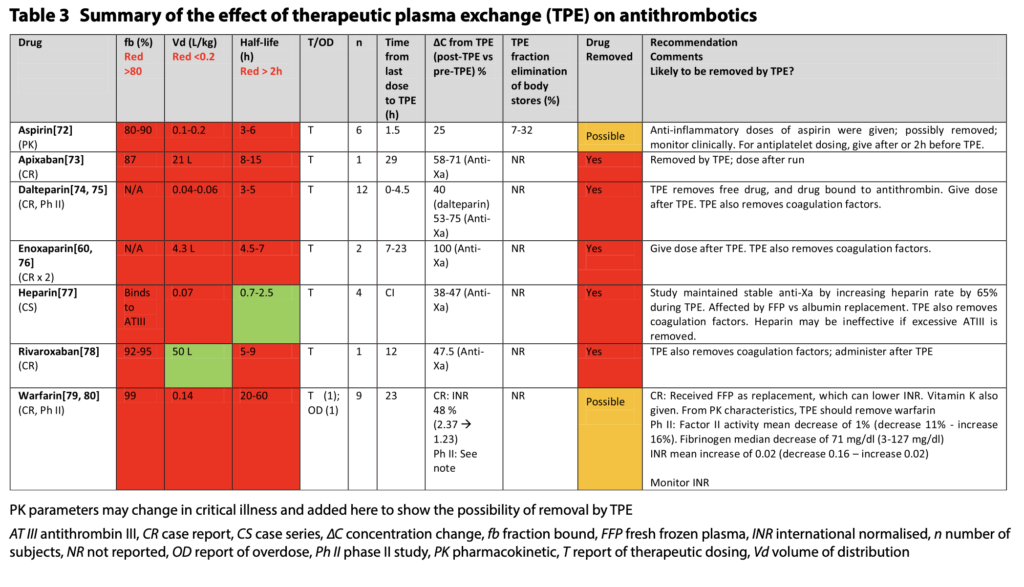
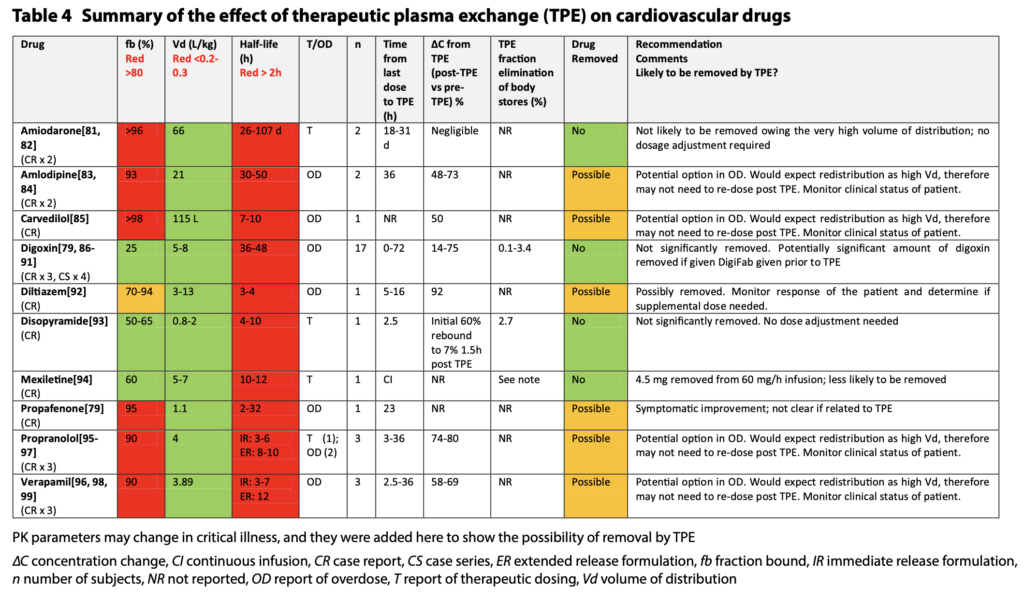
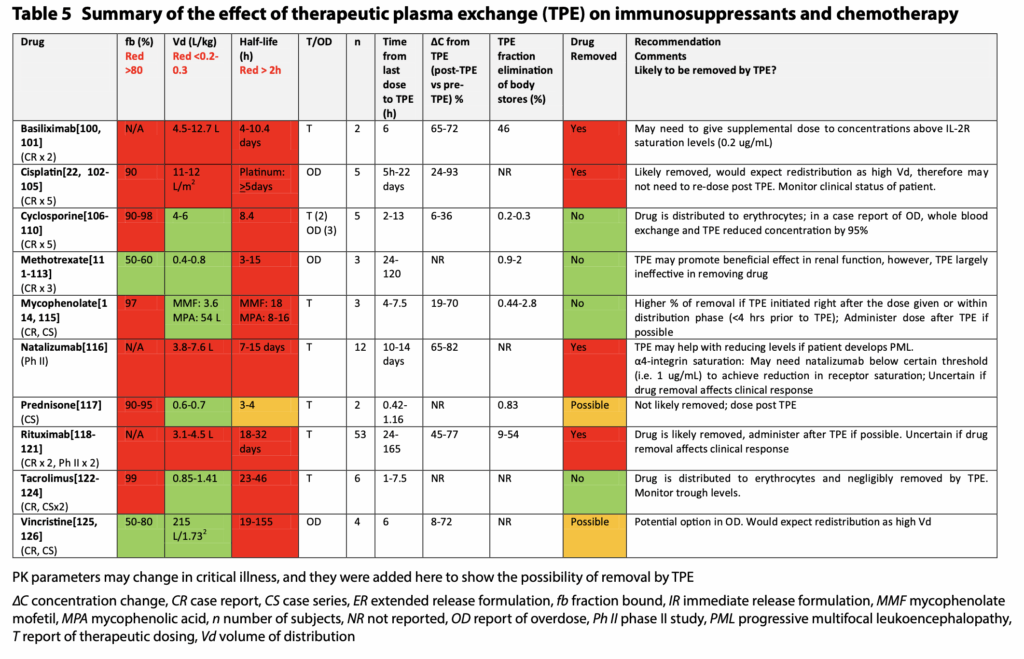
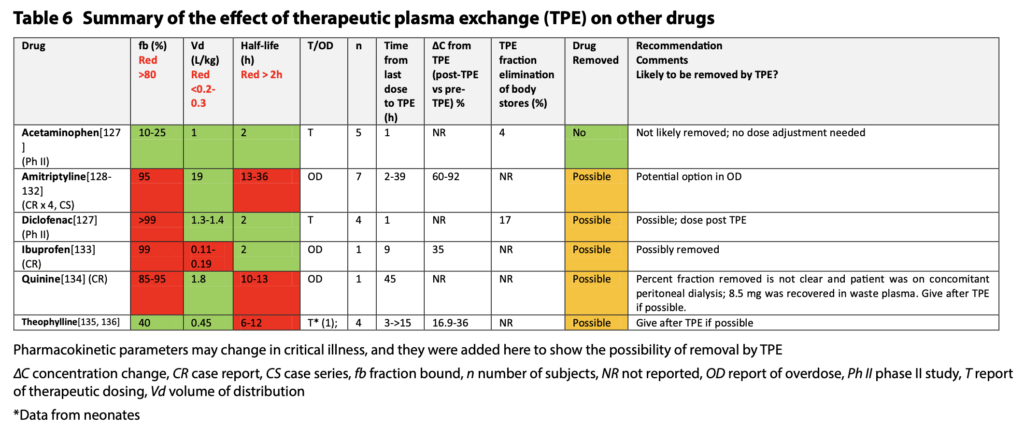
- 注意するべき薬剤
- シクロスポリン(CyA)・タクロリムス(Tac)(いずれもカルシニューリン阻害剤)は、タンパク結合率98%と高値で、半減期も長期で、PEで除去されそうですが、Vdは高く、PEでは除去されないとなっています。
- これはErythrocyteに結合するからで、fbなどだけではPEでの除去率を完全に推定できない好例になっています。
✓リスト(上表にない薬剤の場合)
- Vd<0.2L/kg ・・・分布容積が小さい=ほぼ血液中に存在する ため、除去される可能性がたかい
- fb >80% ・・・タンパク結合率が高い=ほぼ血液中に存在する ため、除去される可能性がたかい
- 半減期>2時間 ・・・代謝が遅いため除去される量が多くなることが推定される
- Distribution phase中にPEが開始されると、多くの薬剤は血液中に存在するため、除去される可能性がたかい
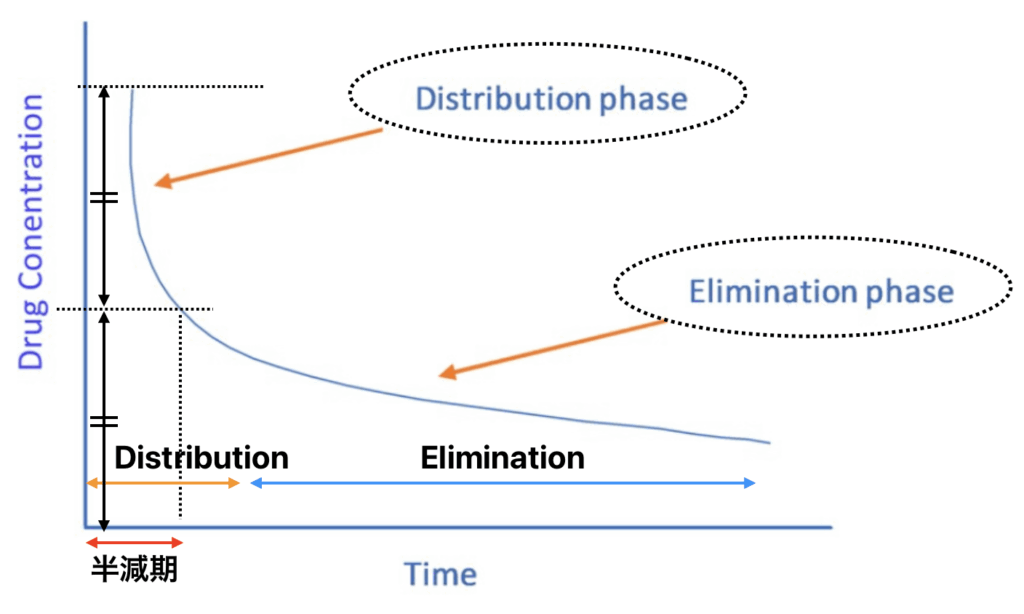
Distribution phaseと半減期について
- 分布半減期は消失半減期よりも短い
- 下の図でいうと、Distribution phase<Elimination phase
- 分布半減期が利用できない場合は、薬物分布を推測するための代理として消失半減期を使用することを提案する
- 例えば、消失半減期が3時間で静脈内ボーラス投与される薬物の場合、TPE開始前に投与後少なくとも3時間待つことを提案する。3時間(1半減期)待つことで、薬物の少なくとも50%が組織に分布することができるため。
Limitation
- 前述したが、本研究では多くは薬物過量投与に関するPEの効果を調査する症例報告をベースに作成されている
- これらの症例報告の多くは、異なる疾患でTPEを受けている患者で研究されており、他の治療法と併用されることが多い
- さらに、多くの症例報告では、異なる期間、量、頻度、PE開始時間が異なり、測定されたエンドポイントも異なるため、比較は基本的に不可能
- さらに、薬物は異なる臨床状況下で異なる挙動を示すため、臨床状況が著しく異なる場合は、以前の知見を現在の臨床に適応できるかどうかは不明
- さらに、報告されたVd、タンパク結合、半減期は、非重篤成人集団の集団平均を利用しており、PEを必要とすることが多い重篤患者では著しく異なる可能性がある
- 従って、本論文のデータやVd・タンパク結合率等で推定する透析除去率は参考にとどめておくべきである
2025/11/08 記述を修正しました



コメント