Two-Year, Randomized, Controlled Trial of Belimumab in Lupus Nephritis
Richard Furie, Brad H. Rovin, Frédéric Houssiau, Ana Malvar, Y.K. Onno Teng, Gabriel Contreras, Zahir Amoura, Xueqing Yu, Chi-Chiu Mok, Mittermayer B. Santiago, Amit Saxena, Yulia Green, Beulah Ji, Christi Kleoudis, Susan W. Burriss, Carly Barnett, David A. Roth
N Engl J Med 2020;383:1117-28.
- この論文のまとめ
- 一言で:ループス腎炎に対して標準治療に加えてベリムマブを投与することで、腎機能をより改善でき、腎関連イベントも減少させた。
- 背景と目的:全身性エリテマトーデスではB細胞が病態に大きく関わり、これを制御するベリムマブはBLISS-52・BLISS-76 trialで効果を示した。ただこの試験では急性・重症のループス腎炎は除外されており、これに対する効果は不明である。したがって活動性のあるループス腎炎患者に対して、標準療法に加えてベリムマブを投与した場合の効果を検証した。
- 結果:ベリムマブ群がプラセボ群に加えて、主要有効腎反応を多く達成し、腎関連イベントも少なかった。
- 実臨床での使いどころ・注意点:
- ループス腎炎患者で既存治療に加えてベリムマブを投与することは場合によって検討される
- 本試験に組み入れられているループス腎炎はeGFR 100程度と、腎機能は保たれている患者が多い
- 標準治療にカルシニューリン阻害剤は併用されておらず、これとの併用での効果は未知数である
- IVCYで寛解導入した群は、MMFで寛解導入した群より効果が乏しく、これがnが少ないためか、患者背景の違いによるかは分からない。
Introduction
背景
- 全身性エリテマトーデス(SLE)は慢性自己免疫疾患で、免疫寛容の喪失により多臓器の炎症と臓器障害を引き起こす
- ループス腎炎はSLE患者の25~60%に発症し、最も一般的な重篤なSLEの徴候であり、疾病と死亡の主要な原因である
わかっていること
- 積極的治療にもかかわらず腎反応を示す患者の割合は依然として低く、患者の10~30%で末期腎疾患に進行する
- このリスクは過去30年間変わっていない
- ベリムマブは組換えヒトIgG-1λモノクローナル抗体で、B細胞活性化因子を阻害し、活動性の自己抗体陽性SLE患者(5歳以上)に承認されている
- BLISS-52およびBLISS-76試験の結果に基づきFDAに承認された
- しかし、これらの試験では急性・重症のループス腎炎患者は除外されていた
わかっていないこと
活動性ループス腎炎患者において、標準療法に追加した場合のベリムマブ静脈投与の有効性と安全性
今回の研究目的
活動性ループス腎炎患者において、標準療法に追加したベリムマブの有効性と安全性を評価すること
Method
21カ国107施設で実施された多国籍多施設試験
研究デザイン
第3相、多国籍、多施設、無作為化、二重盲検、プラセボ対照
Inclusion criteria
- 18歳以上
- 1982年(1997年更新版)米国リウマチ学会のSLE分類基準を満たす
- 組み入れ時の自己抗体陽性SLE(抗核抗体力価80倍以上、抗二本鎖DNA抗体、またはその両方)
- ベースライン6ヶ月以内に生検で証明された活動性ループス腎炎
- 2003 ISN/RPS criteria:クラスIIIまたはⅣ(Class III(C), IV-S(C) and IV-G(C)は除外)(クラスVの併存の有無を問わない)
- 2003 ISN/RPS criteria:純粋なクラスV
- 活動性があり、高用量ステロイドとIVCYまたはMMFによる寛解導入を必要とする
- 蛋白尿(gCre比≧1.0 + 以下の1つ)
- 赤血球(RBC)5個/高倍率視野(hpf)以上または検査室基準範囲を超える
- 白血球(WBC)5個/高倍率視野(hpf)超(または検査室基準範囲を超える)
- 細胞性円柱(赤血球または白血球)の存在
- ただし以下の場合には活動性はなくてもよい
- ベースライン前3ヶ月以内の腎生検でクライテリアを満たす
- 蛋白尿3.5g/day以上
- 蛋白尿(gCre比≧1.0 + 以下の1つ)
- 現在臨床で使用されることの多い2019年EULAR/ACR基準ではANA80倍以上が必須だが、本研究では必ずしも陽性でなくてよい
Exclusion criteria
- 推算糸球体濾過量(eGFR)30 ml/分/1.73 m²未満
- シクロホスファミドとミコフェノール酸モフェチル導入療法の両方の既往失敗
- 片方であれば、もう片方の薬剤で寛解導入する場合に組み入れ可能
- ベースライン(0日目)の60日以内に治療的介入を必要とする重度の活動性中枢神経系(CNS)ループス(痙攣、精神病、器質性脳症候群、脳血管障害[CVA]、脳炎またはCNS血管炎を含む)がある。
- ベースライン1年以内の透析実施歴
- 過去6ヶ月間の自殺行動の既往および/または過去2ヶ月間のColumbia自殺重症度評価尺度(C-SSRS)でタイプ4または5の自殺念慮を含む、重大な自殺リスクのエビデンスがある被験者
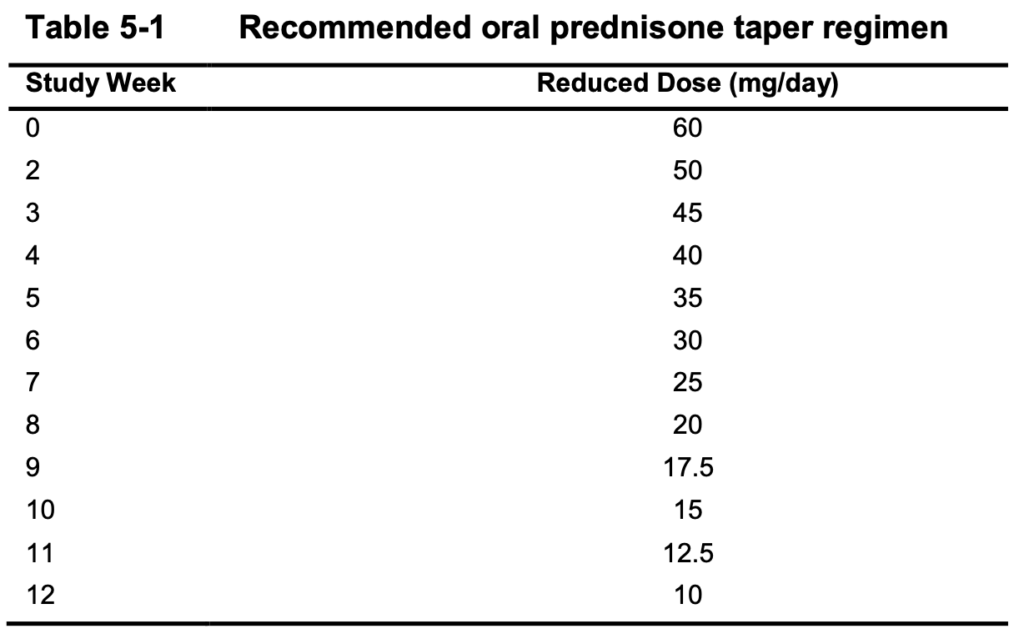
介入
- ベリムマブ静脈投与(10 mg/kg)を標準療法に追加
- 投与スケジュール:1日目(ベースライン)、15日目、29日目、その後100週目まで28日ごと
- 標準導入療法(研究者により選択、1日目の60日前以内に開始):
- 静注シクロホスファミド(500 mg、2週間ごと[±3日]、6回投与)または
- ミコフェノール酸モフェチル(目標用量3 g/日)
- 維持療法:
- シクロホスファミド-アザチオプリン群:最終シクロホスファミド投与2週間後にアザチオプリン開始(目標用量2 mg/kg/日、≤200 mg/日)
- ミコフェノール酸モフェチル群:1~3 g/日(6ヶ月後は1 g/日に減量可能)
- 高用量グルココルチコイド
- メチルプレドニゾロン静注1~3パルス[各500~1000 mg])を導入時に投与可能
- その後、経口プレドニゾン(0.5~1.0 mg/kg/日、総1日量 ≤60 mg)
- 24週までにグルココルチコイドを1日10 mg以下に漸減
- 24週から104週まで1日10 mgを超えてはならない
- ただし、24週から76週の間に、ループス腎炎以外の理由でプロトコルが許可する短期救済治療は例外
- 76週から104週の間はグルココルチコイド救済治療は一切許可されない
ACE阻害薬またはARB、ヒドロキシクロロキンの使用が推奨された
- グルココルチコイドは以下の推奨投与方法がある
- 以下のレジメンから逸脱しても治療失敗とは見なされないが、以下の場合は治療失敗となる
- 24週までにグルココルチコイドを1日10 mg以下に漸減できない
- ループス腎炎増悪の理由で、24週から76週まで1日10 mgを超える
- ループス腎炎以外の理由での増量は、治療失敗にはならない
- 76週から104週の間で1日10 mgを超える
Control
ベリムマブの代わりにプラセボ静脈投与を実施
主要アウトカム
104週時点での主要有効腎反応(Primary Efficacy Renal Response・PERR):
- 尿蛋白/クレアチニン比 ≤0.7
- eGFRがフレア前値より20%以上悪化していないか、≥60 ml/分/1.73 m²
- 治療失敗に対する救済療法の不使用
- 治療失敗:
- グルココルチコイド容量の違反
- 24週までにグルココルチコイドを1日10 mg以下に漸減できない
- ループス腎炎増悪の理由で、24週から76週まで1日10 mgを超える
- ループス腎炎以外の理由での増量は、治療失敗にはならない
- 76週から104週の間で1日10 mgを超える
- この間の増量はいかなる理由でも治療失敗と見なされる
- 追加の免疫抑制療法、新規薬剤、標準療法の容量超過など
- 主要評価項目の定義は、尿蛋白レベルが0.5~0.8 g/日未満への低下が腎疾患患者の長期的腎機能保持の最良の予測因子であり、eGFRが60 ml/分/1.73 m²未満への低下が予後不良の独立予測因子であるという観察に基づく
- 尿沈渣は腎反応評価への寄与が無視できる程度で、混乱を招く可能性があるため、アウトカム指標に含まれていない
- 本試験の完全腎反応の蛋白尿成分は、ほとんどのループス腎炎試験のアウトカム要件と同一であるが、本試験のeGFR反応の要件(フレア前値より10%以上悪化していない、または≥90 ml/分/1.73 m²)は、他のループス腎炎試験のそれよりも厳格である
副次アウトカム
主要な副次評価項目:
- 104週時点での完全腎反応(Complete Renal Response・CRR)
- 尿蛋白/クレアチニン比<0.5
- eGFRがフレア前値より10%以上悪化していない。または ≥90 ml/分/1.73 m²
- 治療失敗に対する救済療法の不使用
- 52週時点でのPERR
- 腎関連イベントまたは死亡までの時間
- 104週時点での尿沈渣を含まないeGFR・蛋白尿の変化
その他の有効性評価項目:
- 経時的なPERRとCRRの達成度
- PERR・CRRを達成するまでの時間
- 尿蛋白レベルおよびバイオマーカーの変化
- eGFRの変化
- 完全腎反応の定義
- 蛋白尿成分は、ほとんどのループス腎炎試験のアウトカム要件と同一
- eGFR反応の要件(フレア前値より10%以上悪化していない、または≥90 ml/分/1.73 m²)は、他のループス腎炎試験のそれよりも厳格である
- 完全寛解として使用されることが多いのは、蛋白尿<0.5g/day + eGFR正常
- 腎関連イベントとは
- 死亡末期腎疾患(ESKD)への進行血清クレアチニンのベースラインからの倍増蛋白尿増加、腎機能障害、またはその両方:
- 蛋白尿増加: 尿蛋白/クレアチニン比の再現性のある増加
- ベースライン<0.2の場合:>1.0への増加
- ベースライン0.2~1.0の場合:>2.0への増加
- ベースライン>1.0の場合:ベースラインの2倍超
- 腎機能障害: eGFRの再現性のある>20%の低下で、かつ以下を伴う:
- 蛋白尿(>1.0 g)
- 細胞性円柱(赤血球、白血球、またはその両方)
- またはその両方
- 腎疾患関連の治療失敗
- なぜ尿沈渣を含まないか
- 尿沈渣は、腎反応の評価への寄与が無視できる程度であり、評価を混乱させる可能性があることから、アウトカム指標に含まれなかった、とある
- バイオマーカーとは何を見ているか
- ANA・抗ds-DNA抗体・抗C1q抗体・抗Sm抗体・C3・C4
- IgGとの比を取った分析も行われている
- 蛋白尿によってIgGが失われるが、その中に自己抗体も含まれるため、蛋白尿が多すぎると自己抗体も見かけ上減少してみえる
- そのためIgGとの比を取ることによって心の自己抗体の量を評価することが可能
解析方法
解析対象集団:
- 有効性評価項目:修正ITT集団(無作為化され、少なくとも1回ベリムマブまたはプラセボを投与されたすべての患者)で解析
- 安全性評価項目:無作為化され、少なくとも1回ベリムマブまたはプラセボを投与されたすべての患者で解析
統計的検定方法:
- 事前に規定された階層に従った段階的逐次検定手順により全体のI型エラーを抑えて解析
- 原文:End points were analyzed with the use of a step-down sequential testing procedure in a prespecified hierarchy to control overall type I error.
- 主要とCRR:ロジスティック回帰分析
- 腎関連イベントまたは死亡までの時間:Cox比例ハザード回帰
- 尿沈渣を含まない序数的腎反応(完全・部分・反応なし):順位共分散分析
- 原文:Ordinal renal response without urinary sediment was analyzed with a rank analysis of covariance
- 事前に規定された階層に従った段階的逐次検定手順により全体のI型エラーを抑えて解析
- 本試験においては主要評価項目が1つ、主要な副次評価項目が4つある
- すべてを別々に検定すると、偶然に「有意差あり」と出る確率が増える
- 例:5%の有意水準で5回検定すると、どれか1つが偶然有意になる確率は約23%に増加する
- 順番に検定し、統計的有意差が確認できたら次へ進む。この方式をとることで、全体のエラーを5%に維持できる
- 1型エラーとは、本当は効果がないのに、効果があると誤って判断してしまう誤りのこと
- 尿沈渣を含まない序数的腎反応:順位共分散分析
- 患者を良い順に並べて、ベリムマブ群の方がプラセボ群より上位にいるかを調べる方法
- 腎反応は、完全・部分、反応なしに分かれているが、「完全」「部分」「無反応」を数値化する適切な方法がないから
- 順位共分散分析(ANCOVA on ranks)においては、以下の順に行う
- 全患者をアウトカムの良い順に順位付け
- CRRの人たち →部分腎反応の人たち →無反応の人たち
- 順位を数値として使って共分散分析
- ベリムマブ群とプラセボ群の平均順位を比較
- 導入レジメン、人種、ベースライン値などの影響を調整
- 判定
- ベリムマブ群の平均順位がプラセボ群より有意に良ければ(上位にいれば)効果あり
調整変数: 統計モデルは導入レジメン、人種・民族、ベースラインの尿蛋白/クレアチニン比、ベースラインeGFRを調整
欠測値の取り扱い: ベリムマブまたはプラセボを中止、治療失敗、試験離脱した患者は反応なしとみなす
Result
研究対象者
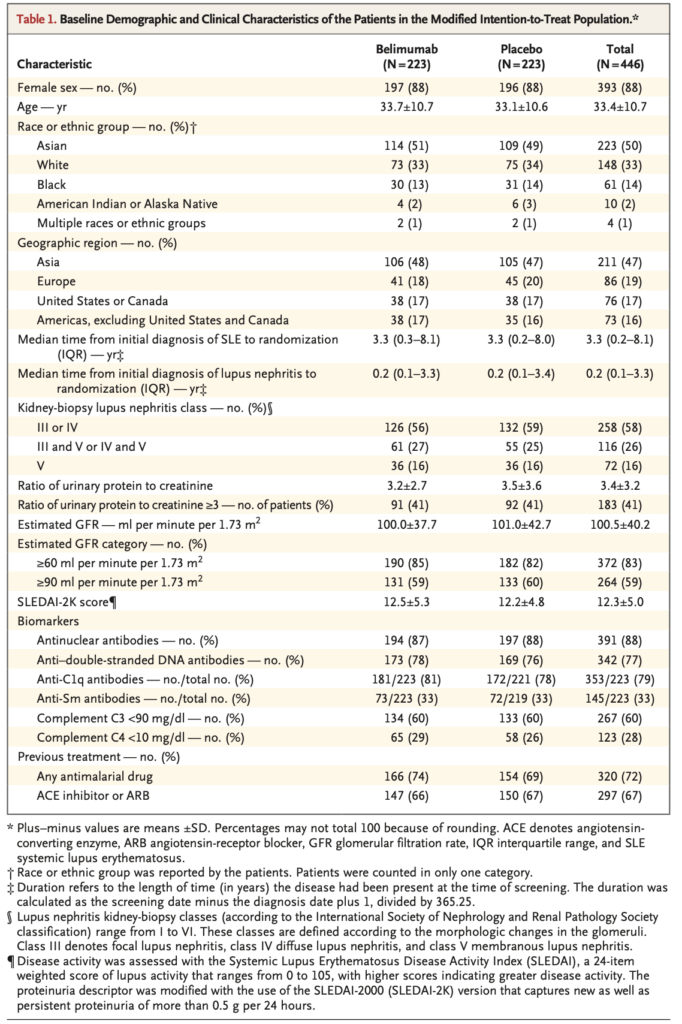
- 2012年7月から2017年7月まで797名がスクリーニングされ、448名が無作為化(ベリムマブ群224名、プラセボ群224名)
- 修正ITT集団は各群223名
- 無作為化は導入レジメン(各群59名がシクロホスファミド、164名がミコフェノール酸モフェチル)と人種(ベリムマブ群31名、プラセボ群32名が黒人、各群192名と191名が非黒人)により層別化
- ベリムマブ群146名(65%)、プラセボ群132名(59%)が100週まで試験薬を継続
- 平均年齢33.4±10.6歳と若い
- ループス腎炎期間の中央値0.2年(四分位範囲0.1~3.3)
- 腎病理
- 58%(446名中258名)が腎生検でクラスIIIまたはIV
- 26%(116名)がクラスIIIまたはIVとクラスVの併存
- 16%(72名)が純粋なクラスV
- およそ91%がprotein creatinine ratio ≧ 3mg
- eGFR 100±35 ml/min/1.73m2程度と、腎機能は保たれている群
- SLEDAI-2K 12±5
- 尿円柱・赤血球尿・蛋白尿・白血球尿は各4点
主要評価項目
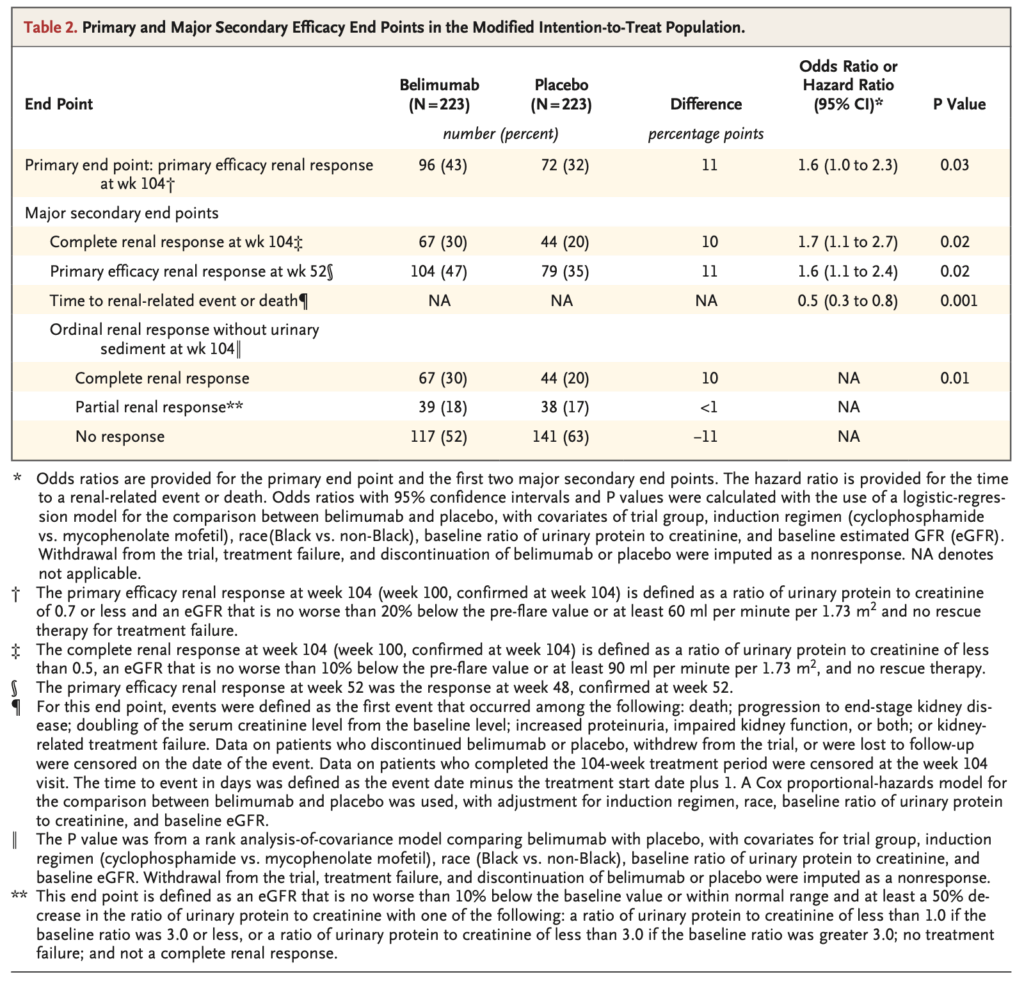
PERR(104週時点):
- ベリムマブ群:96/223名(43%)
- プラセボ群:72/223名(32%)
- OR:1.6(95%CI 1.0~2.3)P=0.03
- 構成酵素の解析
- 104週時点で、尿蛋白/クレアチニン比≤0.7への低下と治療失敗なし:ベリムマブ群でより多く発生
副次評価項目

1. CRR(104週時点):
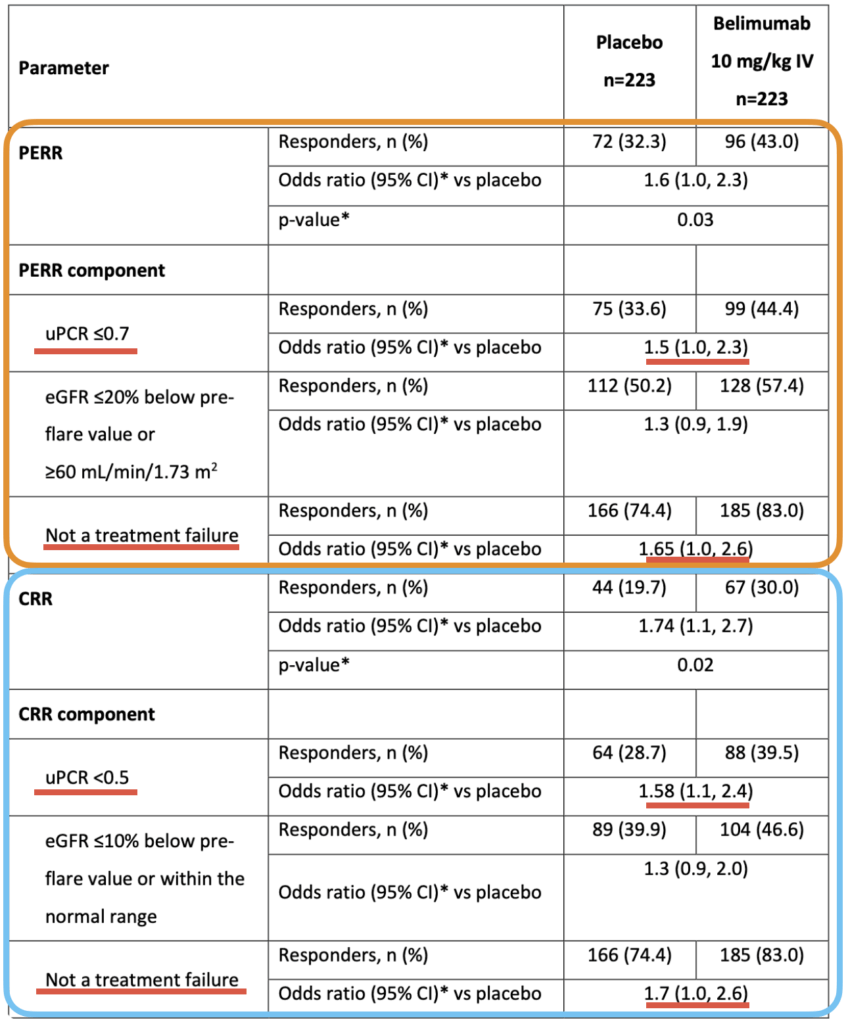
- ベリムマブ群:67/223名(30%)
- プラセボ群:44/223名(20%)
- OR:1.7(95%CI 1.1~2.7)P=0.02
CRRの構成要素の分析:
- ベリムマブ群でプラセボ群より、尿蛋白/クレアチニン比<0.5への低下と治療失敗なしを含む、CRRの各構成要素を達成した患者が多かった。
- 12週以降の各訪問時に、ベリムマブ群でプラセボ群よりもCRRを示した患者が多かった(Figure 1C)。
- 104週まで持続するCRRの可能性:HR 1.58(95%CI 1.08~2.31)(Figure 1D)
- 12週ですでに差がついている
- CRRに差がついた理由として、尿蛋白/クレアチニン比<0.5への低下・治療失敗なし を達成した点があると考えられる
2. PERR(52週時点):
- ベリムマブ群:104/223名(47%)
- プラセボ群:79/223名(35%)
- OR:1.6(95%CI 1.1~2.4) P=0.02
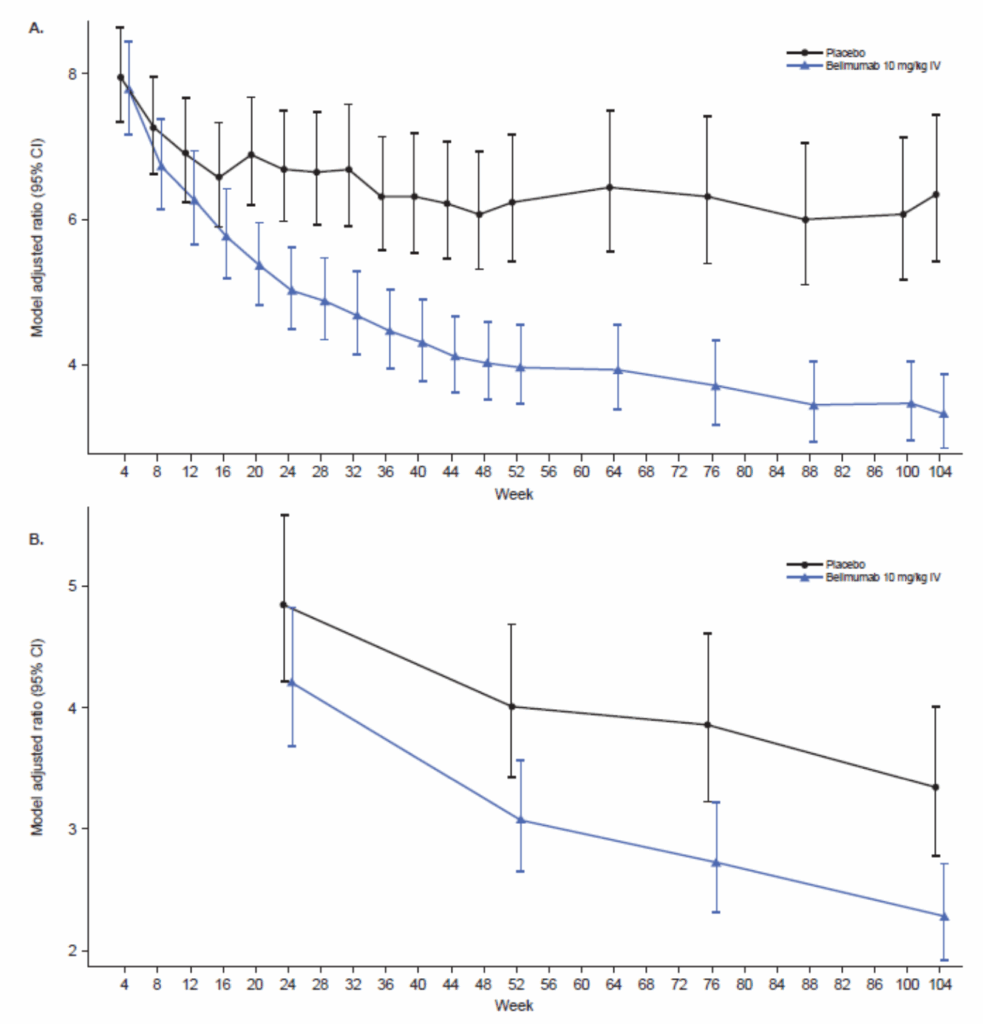
- 24週以降の各訪問時に、ベリムマブ群でプラセボ群よりもPERRを示した患者が多かった(Figure 1A)。
- 52週〜104週まで持続するPERRの可能性:HR 1.46(95%CI 1.07~1.98)(Figure 1B)
3. 腎関連イベントまたは死亡までの時間:
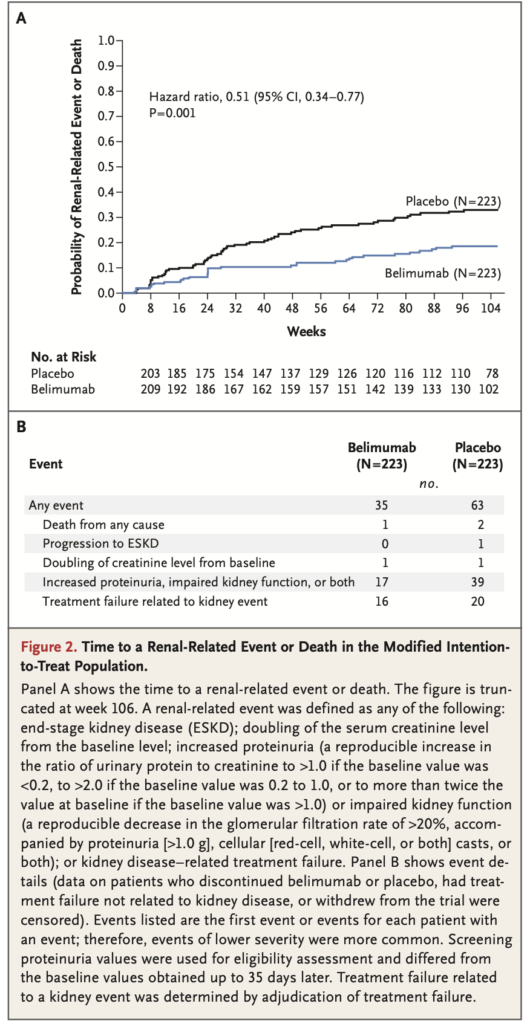
- HR:0.51(95%CI 0.34~0.77)P=0.001
- ベリムマブ群でリスクが有意に低い(Figure 2A)
イベントの詳細(Figure 2B):
- 蛋白尿増加、腎機能障害、またはその両方:ベリムマブ群17名、プラセボ群39名
- 腎関連治療失敗:ベリムマブ群16名、プラセボ群20名
- 末期腎疾患への進行:ベリムマブ群0名、プラセボ群1名
- ベースラインからのクレアチニン倍増:ベリムマブ群1名、プラセボ群1名
- あらゆる原因による死亡:ベリムマブ群2名、プラセボ群1名
4. 尿沈渣を含まない序数的腎反応(104週時点):
- CRR:ベリムマブ群67名(30%)、プラセボ群44名(20%)
- 部分腎反応:ベリムマブ群39名(18%)、プラセボ群38名(17%)
- 無反応:ベリムマブ群117名(52%)、プラセボ群141名(63%)
- P=0.01(順位共分散分析)
- 部分腎反応の定義:
- 以下のすべてを満たすこと
- eGFR基準:
- ベースライン値より10%以上悪化していない
- または正常範囲内
- 尿蛋白の50%減少:
- 尿蛋白/クレアチニン比が少なくとも50%減少
- 尿蛋白の絶対値基準(ベースライン値により異なる):
- ベースライン比≤3.0の場合: 尿蛋白/クレアチニン比<1.0
- ベースライン比>3.0の場合: 尿蛋白/クレアチニン比<3.0
- 治療失敗なし
- 完全腎反応ではない(より厳格な基準を満たしていない)
- eGFR基準:
サブグループ解析
層別化因子によるPERRとCRR(104週時点)の分析(Figure S2):
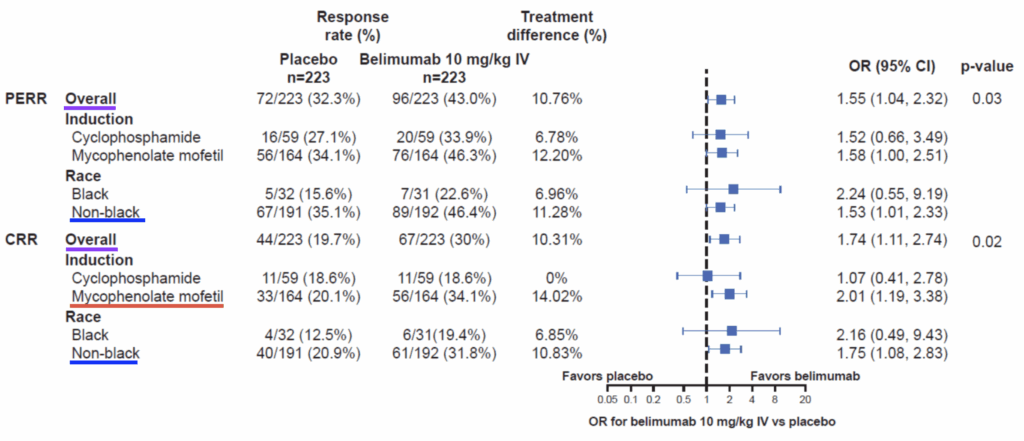
導入レジメン別:
ミコフェノール酸モフェチル群:
- PERR:OR 1.6(95%CI 1.0~2.5)
- CRR:ベリムマブ群でプラセボ群より高率
- 全体的反応はこの大規模群の結果により牽引された
シクロホスファミド-アザチオプリン群:
- PERR:OR 1.5(95%CI 0.7~3.5)
- CRR:両群で同等
ベースライン特性の差異(ミコフェノール酸モフェチル群と比較して、シクロホスファミド-アザチオプリン群でより高い尿蛋白レベル、より低いeGFR、より低い補体濃度、より長い疾患期間、ループス腎炎の以前の治療へのより大きな曝露)は、特にベリムマブを受けた患者において、より大きな腎損傷の蓄積に関連している可能性がある難治性ループス腎炎の患者がより多かったことを示唆している。
人種別:
試験に参加した黒人患者は少数(修正ITT集団446名中61名[14%])であった。
ベリムマブを受けた黒人患者は、プラセボを受けた患者よりも104週時点でPERRとCRRを示す傾向があった。
ただし、両群とも黒人患者の反応率は全体集団よりも低かった。
その他の有効性評価項目
尿蛋白の変化(事後解析): 104週の試験介入を完了した患者のうち:
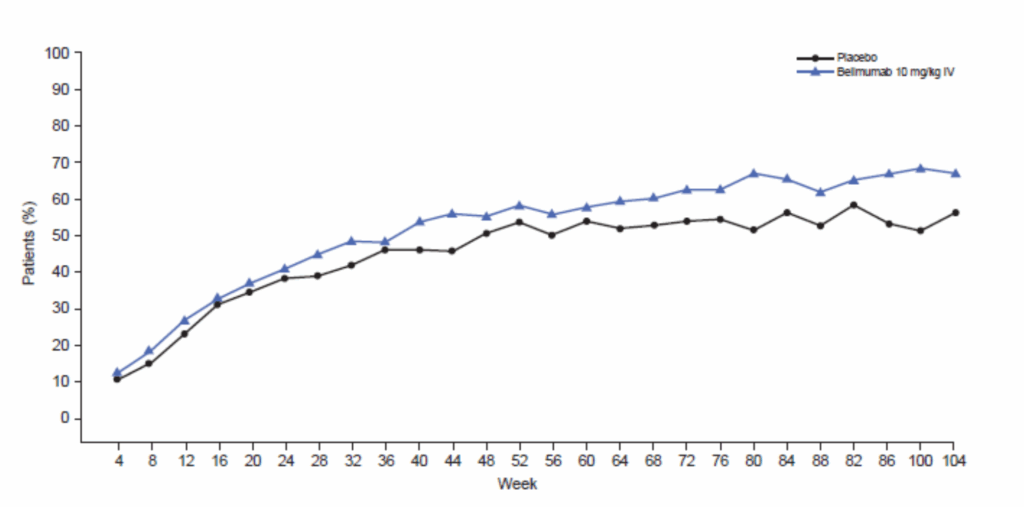
- 尿蛋白/クレアチニン比が≥0.5から<0.5に低下:ベリムマブ群88/131名(67%)、プラセボ群70/124名(56%)
eGFRの変化:
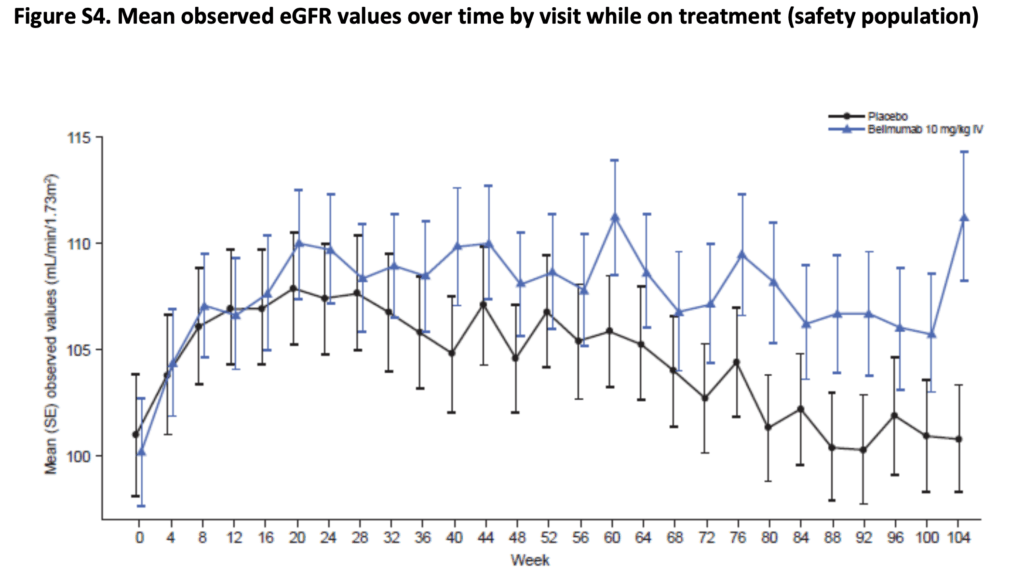
- 両群でベースラインから初期に増加
- 52週以降:プラセボ群でeGFRが低下、ベリムマブ群では104週まで安定して維持
バイオマーカーの変化
自己抗体と補体:
- A・・・抗ds-DNA抗体
- B・・・抗C1q抗体
- C・・・C3
- D・・・C4
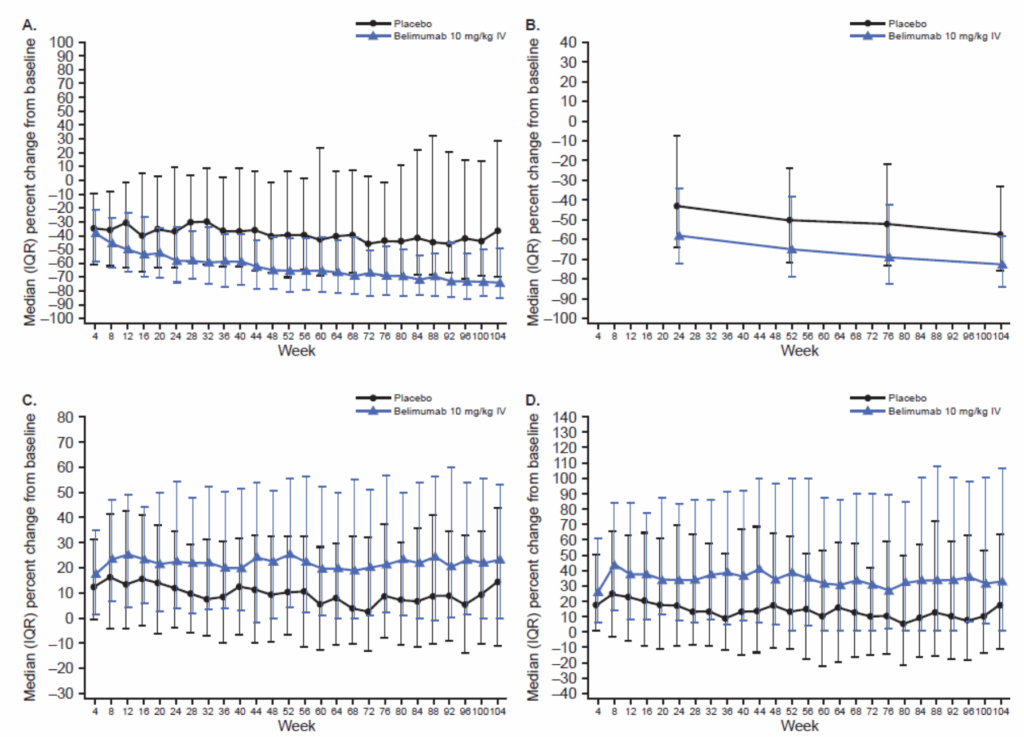
- ベリムマブ群でプラセボ群と比較して:
- 二本鎖DNA抗体とC1q自己抗体がより大きく減少
- 補体C3およびC4レベルがより大きく増加
- 正常値化した例がより多い
IgG血清濃度による正規化後の分析: 蛋白尿の影響を補正するためIgG血清濃度で自己抗体を割った値で評価:
- A・・・抗ds-DNA抗体 / IgG
- B・・・抗C1q抗体 / IgG
- 104週時点での抗二本鎖DNA/IgG比:ベリムマブ群で58%減少、プラセボ群で20%減少
- 抗C1q/IgG比でも同様の減少
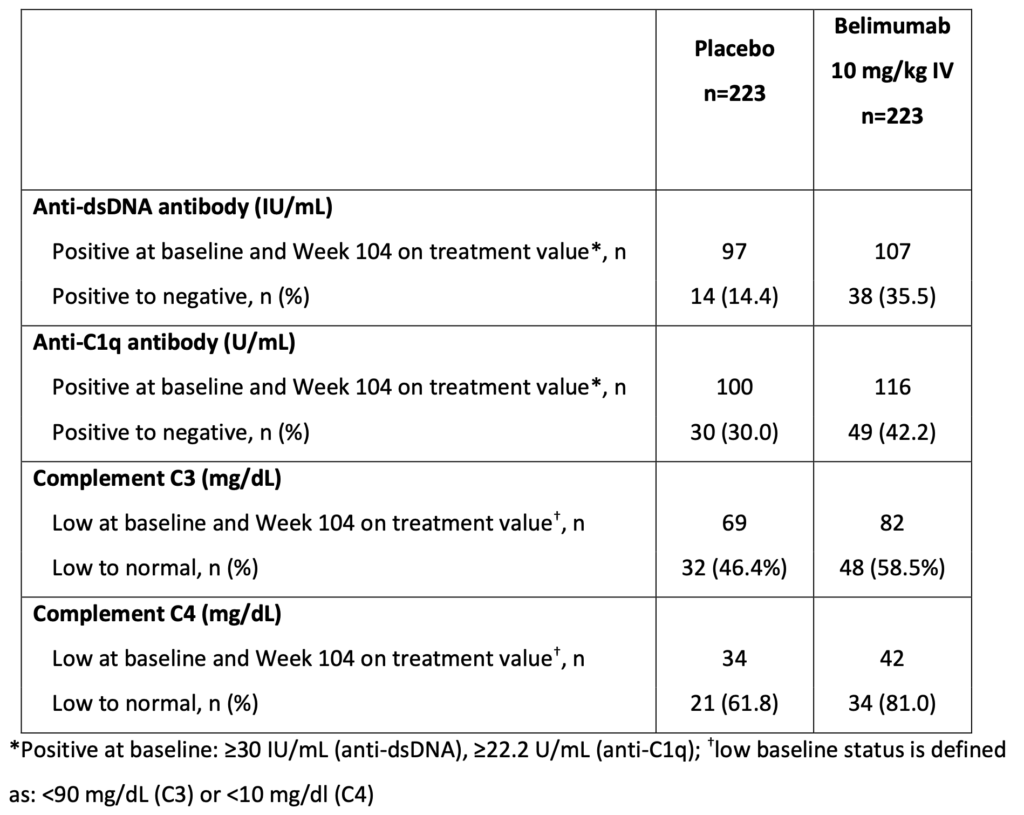
104週時点でバイオマーカーが正常化・陰転化した割合:
安全性評価項目
安全性プロファイル: ベリムマブと標準療法併用の安全性プロファイルは標準療法単独と同様であった。
抗ベリムマブ抗体は検出されなかった。
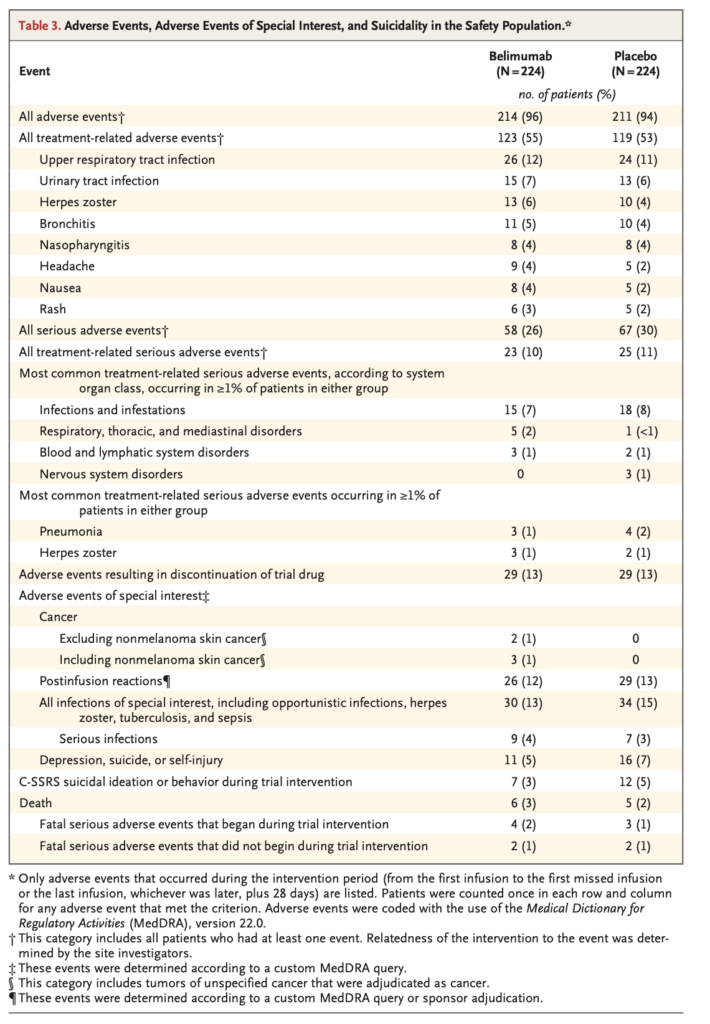
有害事象(Table 3):
- 全有害事象:ベリムマブ群214名(96%)、プラセボ群211名(94%)
- 全治療関連有害事象:ベリムマブ群123名(55%)、プラセボ群119名(53%)
最も頻度の高い治療関連有害事象:
- 上気道感染:ベリムマブ群26名(12%)、プラセボ群24名(11%)
- 尿路感染:ベリムマブ群15名(7%)、プラセボ群13名(6%)
- 帯状疱疹:ベリムマブ群13名(6%)、プラセボ群10名(4%)
- 気管支炎:ベリムマブ群11名(5%)、プラセボ群10名(4%)
重篤な有害事象:
- 全重篤な有害事象:ベリムマブ群58名(26%)、プラセボ群67名(30%)
- 全治療関連重篤な有害事象:ベリムマブ群23名(10%)、プラセボ群25名(11%)
試験薬中止に至った有害事象: 各群29名(13%)
特別な関心のある有害事象:
- 癌(非黒色腫皮膚癌を除く):ベリムマブ群2名(1%)、プラセボ群0名
- 癌(非黒色腫皮膚癌を含む):ベリムマブ群3名(1%)、プラセボ群0名
- 投与後反応:ベリムマブ群26名(12%)、プラセボ群29名(13%)
- 特別な関心のある全感染症(日和見感染、帯状疱疹、結核、敗血症を含む):ベリムマブ群30名(13%)、プラセボ群34名(15%)
- 重篤な感染症:ベリムマブ群9名(4%)、プラセボ群7名(3%)
- 抑うつ、自殺、または自傷:ベリムマブ群11名(5%)、プラセボ群16名(7%)
- C-SSRS自殺念慮または行動:ベリムマブ群7名(3%)、プラセボ群12名(5%)
死亡:
- 試験中の死亡:ベリムマブ群6名(3%)、プラセボ群5名(2%)
- 試験介入期間中に開始した致死的重篤有害事象:ベリムマブ群4名(2%)、プラセボ群3名(1%)
- 試験介入期間中に開始しなかった致死的重篤有害事象:ベリムマブ群2名(1%)、プラセボ群2名(1%)
- 感染関連死:各群3名
- 研究者によりループス腎炎に直接起因すると判定された死亡:なし
Discussion
結果の解釈
- 結果のまとめ
- 標準療法単独と比較して、標準療法にベリムマブを追加した方が、有意に多くの患者が主要評価項目イベントを達成した
- 主要な副次評価項目に関しても、ベリムマブを受けた患者で有意に良好な反応であった
- ループス腎炎患者におけるベリムマブの血清学的検査への効果は、以前の研究と一致した
- ループス腎炎患者に対して、標準療法にベリムマブを追加することは、腎予後を改善する可能性がある
- ミコフェノール酸モフェチル群では、ベリムマブ群でプラセボ群より104週時点でのCRR・PERRを示した患者が有意に多かった。
- より少数のシクロホスファミド-アザチオプリン群では、ベリムマブ群でプラセボ群より104週時点のPERRを示した患者が多かったが、104週時点のCRRでは群間差は認められなかった。
- ベリムマブと標準的なループス腎炎療法の併用が腎反応を増強し、試験期間中の腎関連イベントのリスクをほぼ50%低減することが示された
- 解釈
- ミコフェノール酸モフェチル群とシクロホスファミド-アザチオプリン群の間のベースライン特性における有意な差異(IVCY群が、MMF群と比べて、高い尿蛋白レベル、低いeGFR、低い補体濃度、長い疾患期間、ループス腎炎の以前の治療への曝露)は難治性ループス腎炎の患者がより多かったことを示唆している。
- といいつつも、MMF群とIVCY群のベースラインがどの程度異なるのかについては記載がありません・・・(私の見落としでなければ)
Limitation
- ほとんどの以前のループス腎炎導入試験では、6ヶ月または12ヶ月の主要評価項目を使用し、異なる組み入れ基準とアウトカム指標を使用しているため、本試験の2年アウトカムとの比較は不可能である
- 黒人患者とシクロホスファミド-アザチオプリンを受ける患者の登録が少ない
- バックグラウンド療法として許可されたのは2つの導入および維持レジメンのみ(カルシニューリン阻害薬など、現在臨床で使用されている追加のループス腎炎療法は含まれていない)
- 患者報告アウトカムが含まれていない
- ベースラインの血清クレアチニンが低値の患者では、絶対値の小さな増加が比較的大きなeGFRの変化をもたらし、このような患者は反応なしとして不適切に分類されるリスクがある
- その救済として、eGFR≧90 ml/分/1.73 m²という要素がある
- この現象とグルココルチコイド漸減要件および評価項目確認が、104週時点でのCRRの発生率が一見低い(ベリムマブ群30%、プラセボ群20%)ことの一因となっている可能性がある
- ループス腎炎の予後は人種差があり、黒人では予後が悪い可能性が指摘されています
- Kidney Int 1994;45:544-50.
- Kidney Int 2006;69:1846-51.
- J Am Soc Nephrol 2007;18:244-54.
臨床への影響
- Ⅲ・Ⅳ・Ⅴ型のループス腎炎に対して、標準治療に加えてベリムマブを投与することで、腎予後を改善する可能性がある
この試験のよい点
- 大規模な国際多施設共同研究(21カ国107施設、448名)で実施された点
- 2年間という長期の二重盲検治療期間により、早期反応と治療の持続性の両方を評価可能
- 2年間の二重盲検治療期間により、早期反応と治療の持続性の両方を評価可能である点。
- ほとんどのループス腎炎試験ではシクロホスファミドを受けている患者を除外しているが、本試験では組み入れている
- 本試験の評価項目には、グルココルチコイド用量の持続的減量と、2回の連続訪問でのPERRおよびCRRの確認という追加の厳格な反応要件がある
- 本試験のCRRの蛋白尿成分はほとんどのループス腎炎試験のアウトカム要件と同一だが、eGFR反応の要件(フレア前値より10%以上悪化していないか≥90 ml/分/1.73 m²)は他のループス腎炎試験より厳格である
悪い点
- 黒人患者の登録が少なく(全体の14%)、より予後不良とされる集団での有効性評価が限定的
- シクロホスファミド-アザチオプリン群のサンプルサイズが小さく(各群59名)、このレジメンでの有効性評価が限定的
- バックグラウンド療法が2つのレジメンに限定され、カルシニューリン阻害薬などの他の治療オプションが含まれていない
- 患者報告アウトカムが評価されていない
- シクロホスファミド-アザチオプリン群とミコフェノール酸モフェチル群のベースライン特性に差異があり、サブグループ解析の解釈を複雑にしている
- 104週以降の長期予後データがない
2025/12/21 一部修正しました



コメント