A Phase 3 Trial of Telitacicept for Systemic Lupus Erythematosus
Ronald F. van Vollenhoven, Li Wang, Joan T. Merrill, Yi Liu, Chunde Bao, Fen Li, Jiankang Hu, Chenghui Huang, Jianhong Zhao, Cibo Huang, Hanyou Mo, Wei Wei, Fu’ai Lu, Jingyang Li, Dongbao Zhao, Wenxiang Wang, Lin Li, Qing Zuraw, Xiaofei Wang, Xuebin Wang, Jianmin Fang, Fengchun Zhang, for the 18C010 Trial Investigators
N Engl J Med 2025;393:1475-85.
Introduction
背景
全身性エリテマトーデス(SLE)は深刻な慢性自己免疫疾患であり、診断後2~6年以内に患者の半数以上で検出可能な臓器障害が発生する。現在の治療にはグルココルチコイド、抗マラリア薬、免疫抑制剤、生物学的製剤が含まれるが、より安全で効果的な治療法が依然として必要とされている。
B細胞はSLEの病態形成において中心的な役割を果たす。B-lymphocyte stimulator(BLyS)はB細胞の分化、成熟、機能、生存の主要な調節因子である。自己免疫疾患患者、特にSLE患者ではBLySレベルの上昇が認められる。BLySを結合・中和するモノクローナル抗体であるbelimumabの試験成功により、このサイトカインがSLE患者の治療標的として重要であることが示された。しかし、多くのSLE患者はbelimumabに反応しないか、部分的な反応しか示さない。
APRIL(a proliferation-inducing ligand)というサイトカインもB細胞の分化と成熟に影響を与え、APRILレベルはSLE患者で関節リウマチ患者や健常者よりも高いことが判明している。
わかっていること
- Belimumab(BLySを標的とするモノクローナル抗体)はSLEにおいて有効性を示した
- APRILもB細胞の分化・成熟に影響し、SLE患者でレベルが高い
- TelitacicceptはBLySとAPRILの両方を阻害する二重阻害剤である
- Phase 2b試験でtelitaciceptは活動性SLE成人患者において、標準療法に追加した際に有効性を示した
- Phase 2bの試験
- Telitacicept in patients with active systemic lupus erythematosus: results of a phase 2b, randomised, double-blind, placebo-controlled trial. Ann Rheum Dis 2024;83:475-87.
わかっていないこと
- BLySとAPRILの両方を阻害することがSLE治療に有用で安全かどうか
今回の研究目的
中国人の活動性SLE患者において、週1回160mgのtelitacicept投与とプラセボを比較した有効性と安全性を評価すること
Method
Setting
中国の42施設
研究デザインのType
第3相、二重盲検、ランダム化、プラセボ対照試験
Inclusion criteria
- 18~65歳
- American College of Rheumatology 1997年改訂分類基準を満たすSLE患者
- 抗核抗体または抗dsDNA抗体のいずれかが陽性
- 組み入れ時、SELENA-SLEDAIスコア8以上、Clinical SELENA-SLEDAIスコア6点以上
- Clinical SELENA-SLEDAI=抗dsDNA抗体・低補体血症を除いたSELENA-SLEDAI
- telitacicept/placebo初回投与前、少なくとも30日間、安定した標準治療を受けている
- 標準治療とは、以下の薬剤かその組み合わせをいう
- グルココルチコイド
- 抗マラリア薬
- NSAIDs
- 他の免疫抑制薬(アザチオプリン・ミコフェノール酸・シクロフォスファミド・メトトレキサート・レフルノミド・タクロリムス・シクロスポリン)
- BLISS-52、TULIP-2では、SELENA-SLEDAI≧6、Clinical SELENA-SELDAI≧4と定義されているため、ややInclusion criteriaが高い。ただ実際の組み入れられた患者のSELENA-SLEDAIが他試験と比較して高いわけではない
Exclusion criteria
- 重症活動性ループス腎炎 ・・・6g/24h または 血清クレアチン>2.5mg/dL
- 活動性腎炎 ・・・プロトコルで禁止されている薬剤を要する、透析を必要としたことがある、グルココルチコイド100mg/day以上・14日以上を8週間以内に必要とした患者
- CNSループス ・・・8週間以内に生じたもの
- 妊娠
- B細胞を標的とした薬剤(rituximabなど)による1年以内の治療歴
介入
- Telitacicept 160mgを週1回皮下投与、52週間(安定した標準治療に追加)
- グルココルチコイド投与量について
- 最初の24週間は、グルココルチコイド用量(prednisoneまたは同等量)を増量できたが、ベースライン用量の25%以内または5mg(いずれか高い方)まで戻す必要があった。それ以上の増量は許可されなかった。
- SLE疾患活動性が少なくとも4週間減少した場合、グルココルチコイドの漸減が推奨された(必須ではない)。16週後の抗マラリア薬または免疫抑制剤の用量追加または変更は治療失敗とみなされ、試験からの中止が必要とされた。
- 24週〜44週までは、ベースラインから25%以上または5mg以上の増量は、プロトコル違反とされた。
- 44週〜は、グルココルチコイドの増量はプロトコル違反と見なされた。また、ベースラインから25%より上または5mgより上の量を使用した場合は治療失敗と見なされた
- プロトコル違反と治療失敗の扱いについてはProtocolを調べた限りでは明記されていなかった。
- 本文では治療失敗のみの記載であり、プロトコル違反でも治療は継続されたのか、治療失敗と同様にみなしたのかは不明
Control
プラセボを週1回皮下投与、52週間(安定した標準治療に追加)
主要アウトカム
52週時点でのmodified SLE Responder Index 4(SRI-4)における反応
Modified SRI-4の定義:
- SELENA-SLEDAIスコアのベースラインから4点以上の減少
- BILAG indexでA(重度)スコアまたは2つ以上のB(中等度)スコアの新規疾患活動性がない
- Physician’s Global Assessment(PGA)スコアの悪化がない(ベースラインから0.3点未満の増加)
- 本論文では”modified”SRI-4とされているが、BLISS-52ではSRI-4として同様の主要評価項目となっている
- 本論文では、BILAG Aなし・Bなしを(Modifiedのない)SRI-4として、Post hocで解析されている
副次アウトカム
副次アウトカムは多重性が制御されておらず、点推定値と95%信頼区間として報告された:
- 52週までのSELENA-SLEDAIスコアの4点以上の減少
- 52週までのPGAスコアのベースラインからの変化
- 44~52週でのグルココルチコイド用量のベースラインから25%以上の減少または1日7.5mg以下への減少
- IgG、IgA、IgM、CD19+ B細胞、抗dsDNA抗体、C3、C4レベルのベースラインからの変化
- フレアまでの時間(日数)(SLEDAI Flare Indexで定義)
安全性解析
解析方法
サンプルサイズ:
Telitacicceptとプラセボのmodified SRI-4における反応の差を検出するために、135人の参加者が85%の検出力を提供すると推定された。仮定には、両側検定でα=0.05、β=0.15、群間差18.9パーセントポイント(中国でのtelitacicept phase 2b試験と北東アジアでのbelimumab phase 3試験から決定)が含まれた。15%の脱落率を見込んで、1:1ランダム化で318人のサンプルサイズが計画された。
有効性解析:
Full analysis population(ランダム化されtelitacicept/placebo少なくとも1回投与を受けたすべての参加者)で実施。
Modified SRI-4の反応分析では、試験から脱落または併用薬のプロトコル制限変更があった参加者は治療失敗とみなされた。調整リスク差は、試験群と層別化因子を共変量とするロジスティック回帰モデルに基づく最小二乗平均から得られた。リスク差の標準誤差は、ブートストラップ法を用いて1000回のサンプリングにより推定し、調整差の両側95%信頼区間を得た。欠測データは非反応として代入された。
共変量として試験群・ベースラインSELENA-SLEDAIスコア(≤9 vs >9)・ベースライン補体レベル(低値 vs 正常値)が使用された。
追加の感度分析がSupplementary Appendixで報告された。
安全性解析:
Telitacicept/placebo少なくとも1回投与を受け、治療後安全性測定値の実際のデータが記録されたすべての参加者を対象に、Fisherの正確確率検定を使用して実施。
データはSAS software version 9.4で分析された。
Result
研究対象者
2019年10月から2022年4月までに、SLE患者433人がスクリーニングされ、335人が無作為化された:
- Telitacicept群: 167人 →52週の治療完遂 128人(脱落39人、治療失敗7人、有害事象8人)
- Placebo群: 168人 →52週の治療完遂 108人 (脱落60人、治療失敗34人、有害事象8人)
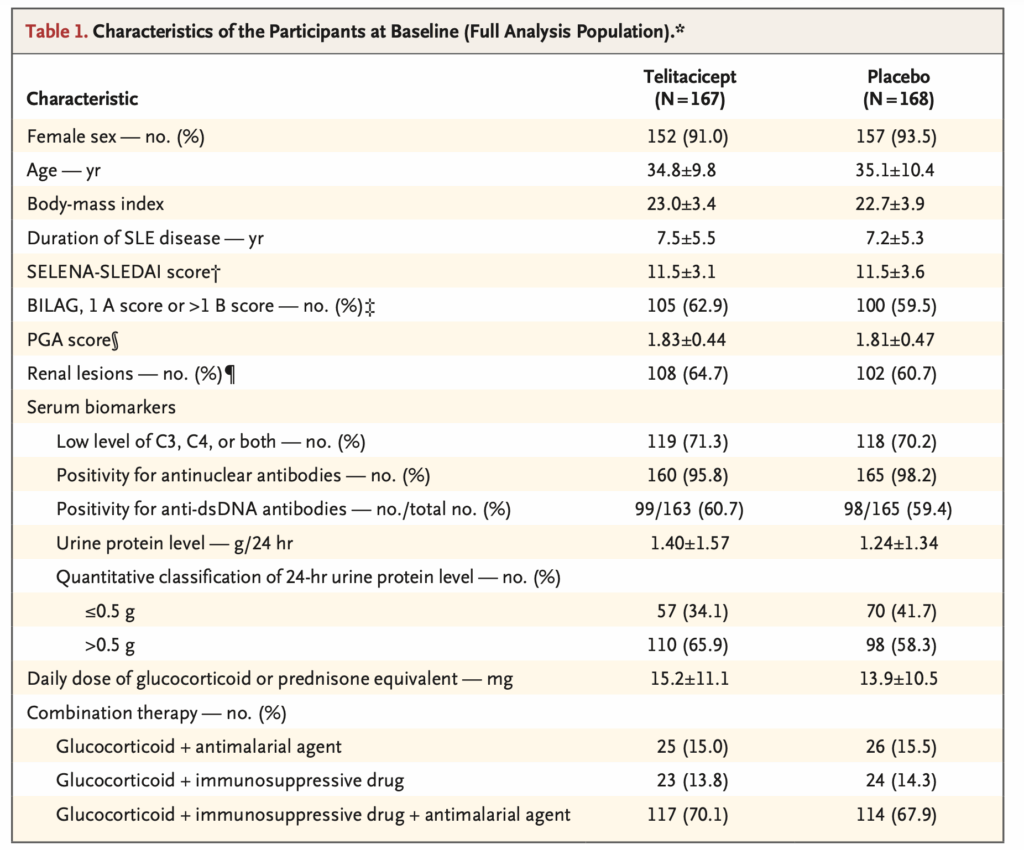
ベースライン特性: 試験群は人口統計学的特性、臨床的特徴、ベースライン時の治療についてよくバランスがとれていた。
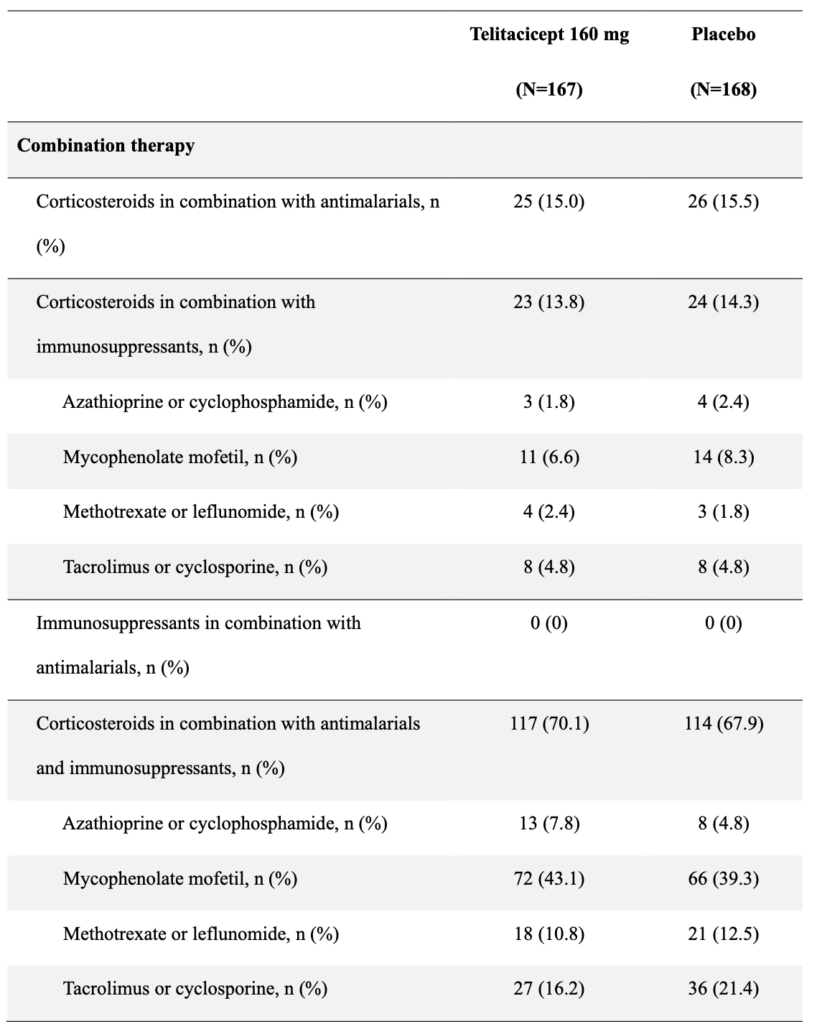
最も一般的なSLE症状は粘膜皮膚、免疫学的、腎症状で、69.0%の参加者がグルココルチコイドを抗マラリア薬と免疫抑制剤と併用し、72.2%がベースラインでprednisone換算で1日7.5mg以上を服用していた。
この場合の腎症状とは、1997ACR基準における赤血球円柱・細胞性円柱・またはその両方。シクロホスファミドの治療は335例中28例(8.4%)で報告された。
- 試験脱落が39人/167人・60/168人と多い
- BLISS-52、TULIP-2と比較して、GC+HCQ+免疫抑制薬を使用されている患者が多い
- BLISS-52・・・免疫抑制薬使用者が42%程度
- TULIP-2・・・免疫抑制薬使用者が50%程度
- GC投与量が多い
- BLISS-52・・・13mg±9mg程度
- TULIP-2・・・10mg±7mg程度
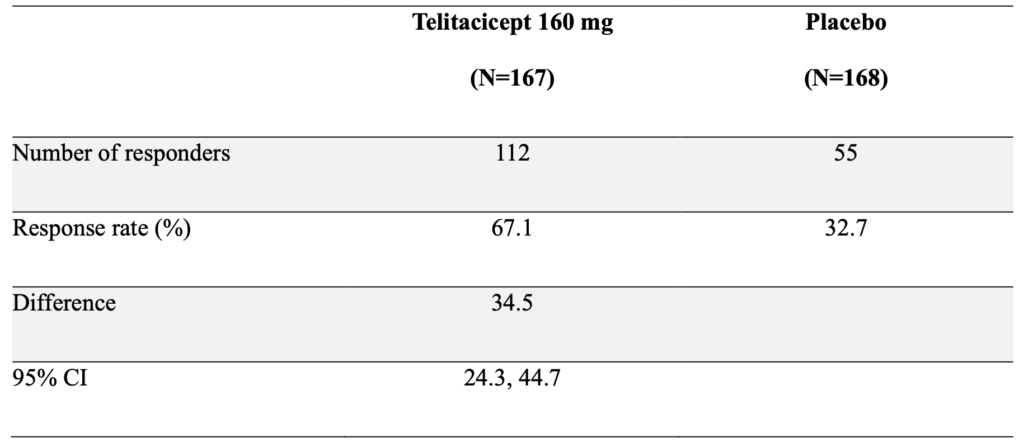
主要評価項目
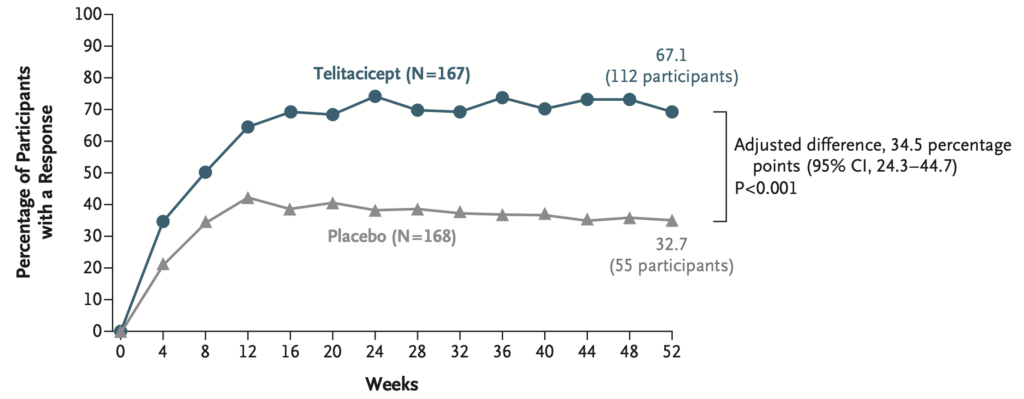
52週時点でのmodified SRI-4反応:
- Telitacicept群: 67.1%(112人)・Placebo群: 32.7%(55人)
- 調整差: 34.5パーセントポイント(95% CI: 24.3~44.7)
- P<0.001
Telitacicept投与を受けた参加者は、早くも4週目からプラセボ投与者よりも多くmodified SRI-4反応を示し、この差は52週まで持続した。
感度解析
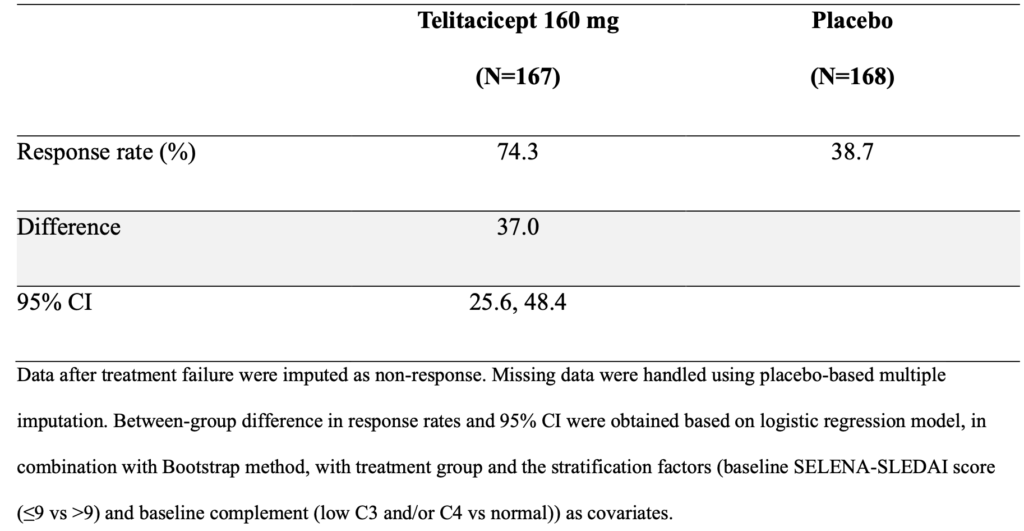
SRI-4反応の基準を「SELENA-SLEDAIスコアのベースラインから4点以上の減少、BILAG indexでAまたはBスコア(1つ以上のBスコアではなく)の新規疾患活動性がない、PGAスコアの悪化がない」と定義した場合、52週時点の反応率はmodified SRI-4基準を使用した場合と同じだった
副次評価項目
多重性の評価をされていないので、それぞれのP値は記載されていない。
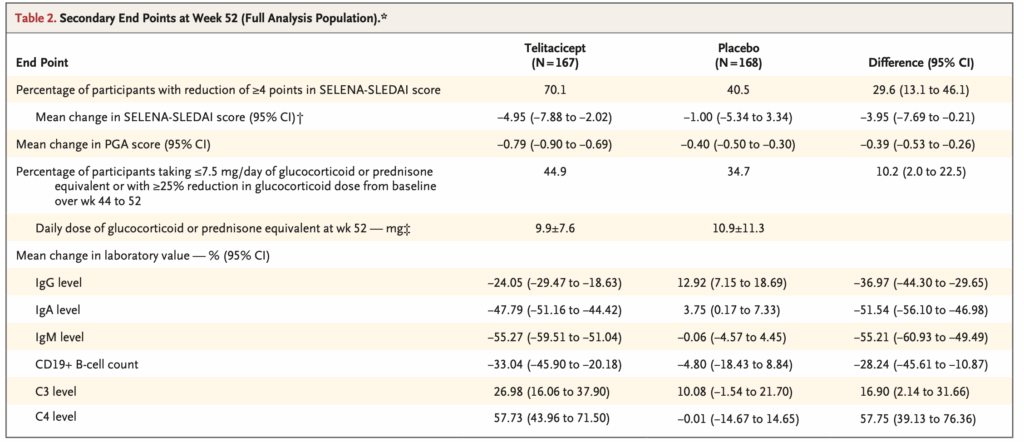
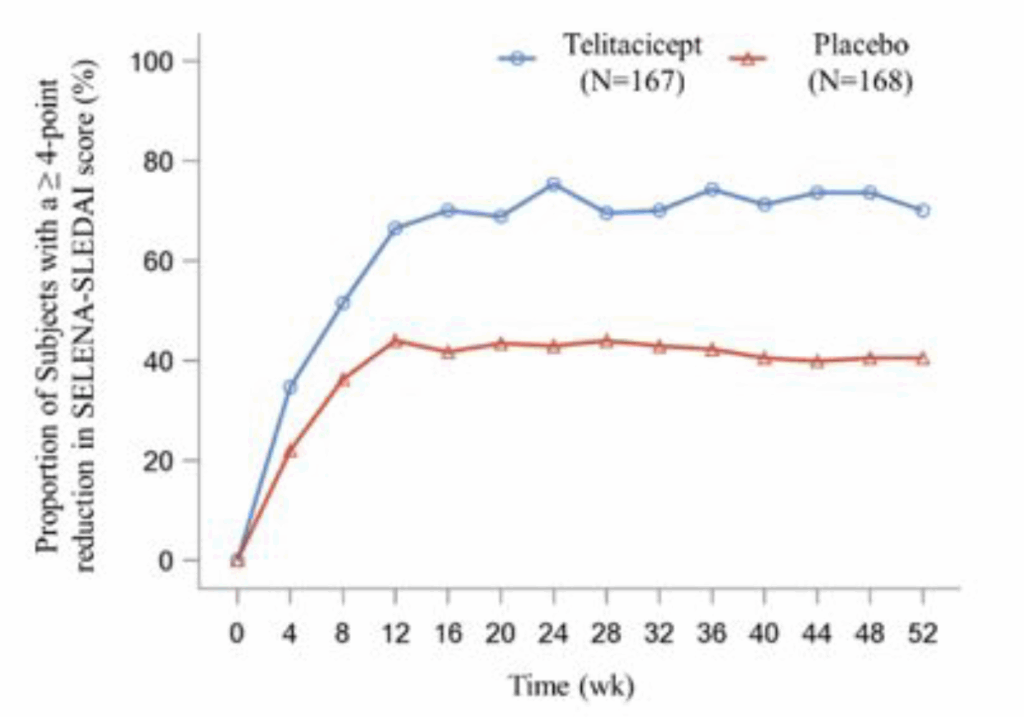
SELENA-SLEDAIスコアの4点以上の減少(52週時点):
- Telitacicept群: 70.1%
- Placebo群: 40.5%
- 差: 29.6パーセントポイント(95% CI: 13.1~46.1)
52週まで持続的にSELENA-SLEDAIスコアの4点以上の減少を示した参加者はtelitacicept群でplacebo群より多かった
事後解析: SELENA-SLEDAIスコアの平均変化:
- Telitacicept群: −4.95
- Placebo群: −1.00
- 差: −3.95(95% CI: −7.69~−0.21)
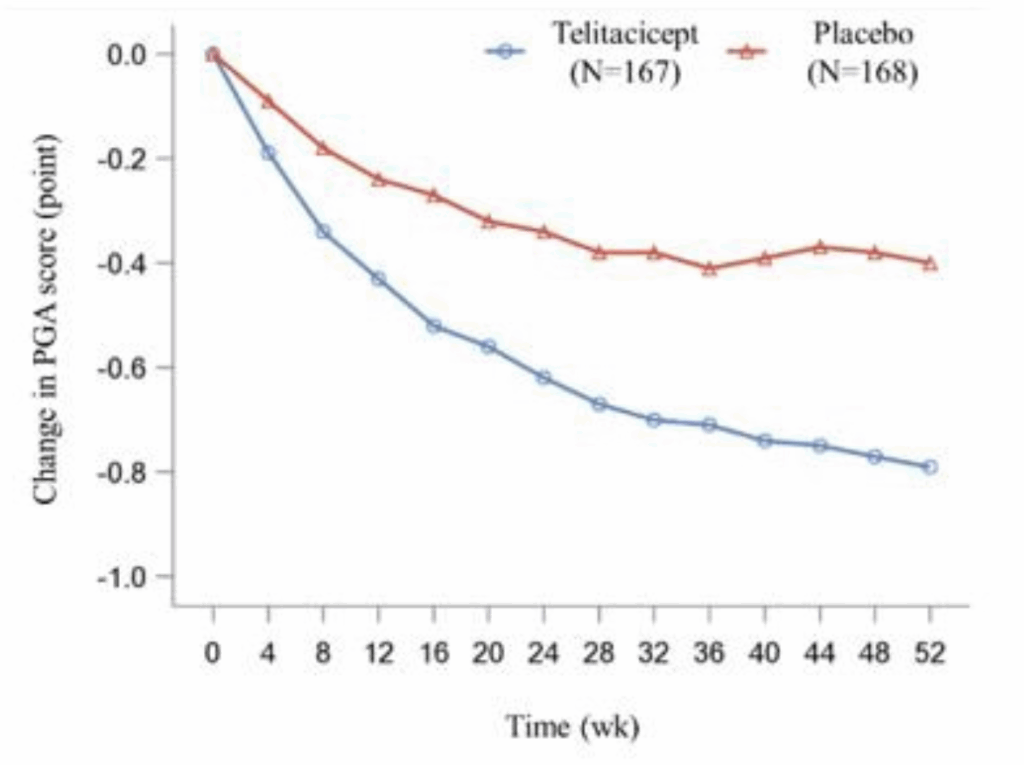
PGAスコアのベースラインから52週までの変化:
- Telitacicept群: −0.79
- Placebo群: −0.40
- 差: −0.39(95% CI: −0.53~−0.26)
44~52週でグルココルチコイド1日7.5mg以下またはベースラインから25%以上減少:
- Telitacicept群: 44.9%
- Placebo群: 34.7%
- 差: 10.2パーセントポイント(95% CI: 2.0~22.5)
- BLISS-52の患者群では、44~52週でグルココルチコイド1日7.5mg以下またはベースラインから25%以上減少はPlacebo群で12%であったので患者層が大きく異なる
- 本試験の方が、ベースのステロイドがやや多いこと、免疫抑制薬の併用患者数が多いことが関係しているかもしれないが、不明。
52週時点の平均(±SD)グルココルチコイド1日投与量(prednisone換算):
- Telitacicept群: 9.9±7.6 mg
- Placebo群: 10.9±11.3 mg
52週時点での血清レベルのベースラインからの変化率(平均):
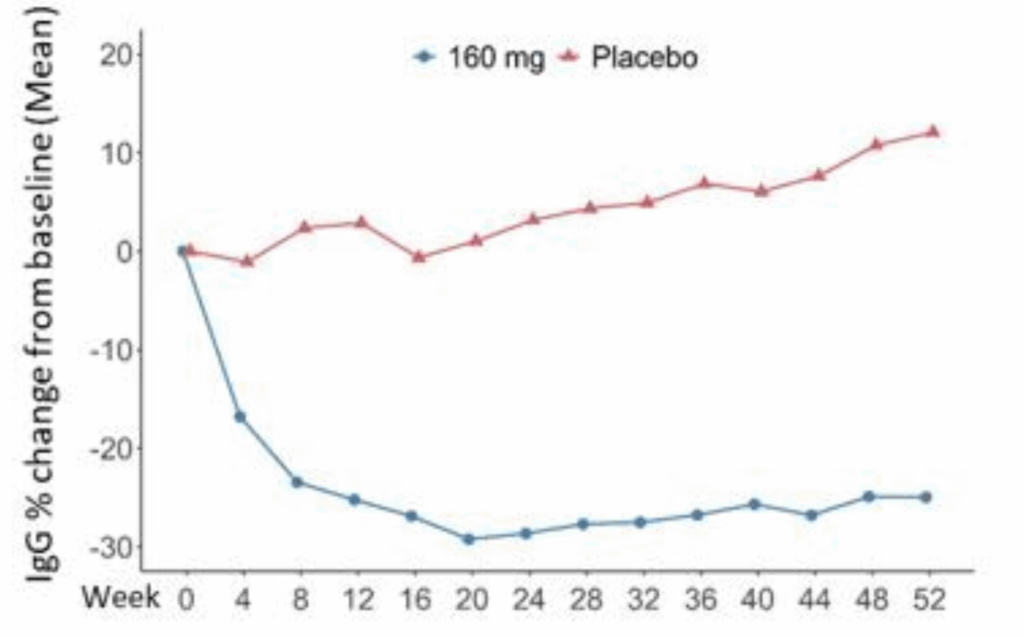
IgGレベル:
- Telitacicept群: −24.05%(95% CI: −29.47~−18.63)
- Placebo群: 12.92%(95% CI: 7.15~18.69)
- 差: −36.97%(95% CI: −44.30~−29.65)
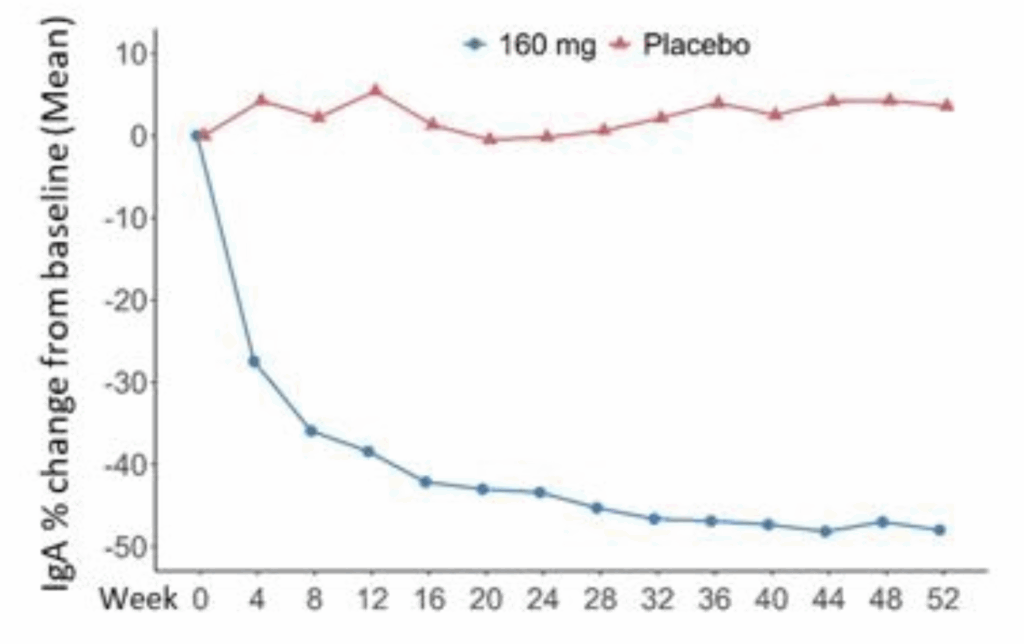
IgAレベル:
- Telitacicept群: −47.79%(95% CI: −51.16~−44.42)
- Placebo群: 3.75%(95% CI: 0.17~7.33)
- 差: −51.54%(95% CI: −56.10~−46.98)
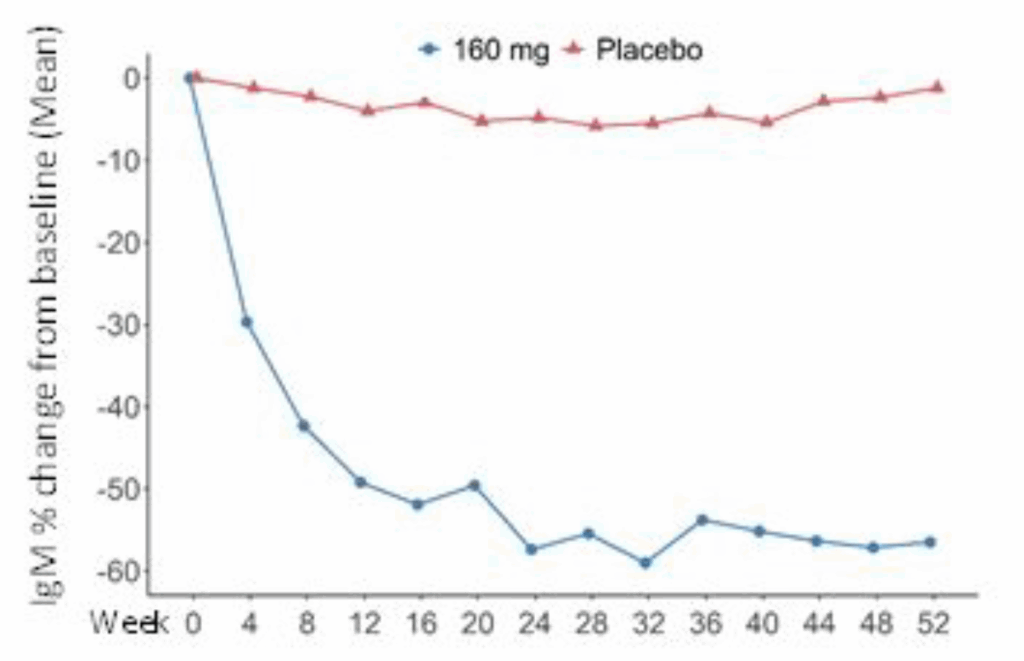
IgMレベル:
- Telitacicept群: −55.27%(95% CI: −59.51~−51.04)
- Placebo群: −0.06%(95% CI: −4.57~4.45)
- 差: −55.21%(95% CI: −60.93~−49.49)
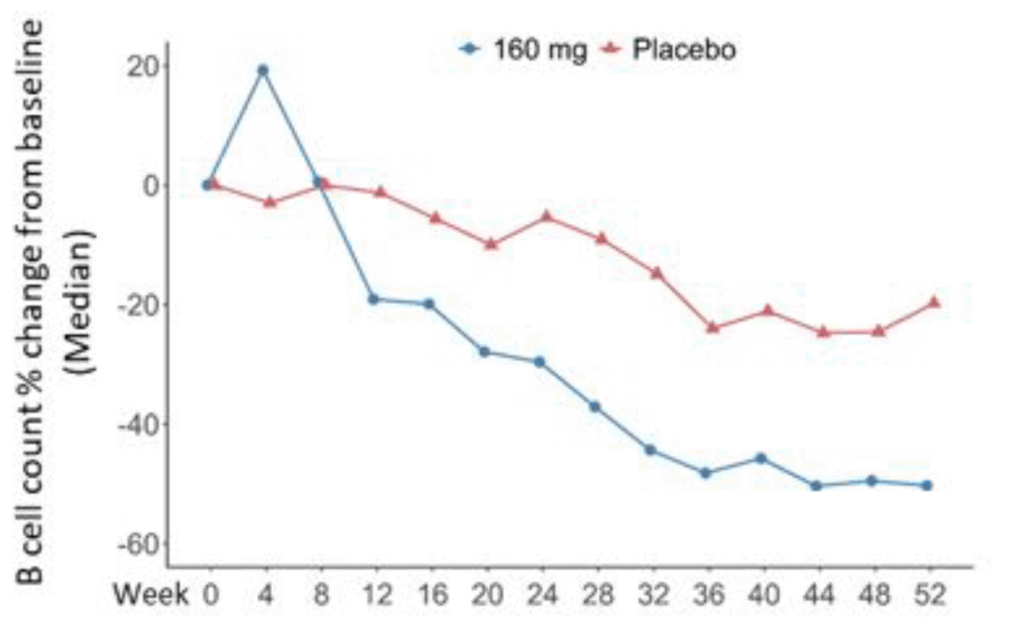
CD19+ B細胞数:
- Telitacicept群: −33.04%(95% CI: −45.90~−20.18)
- Placebo群: −4.80%(95% CI: −18.43~8.84)
- 差: −28.24%(95% CI: −45.61~−10.87)
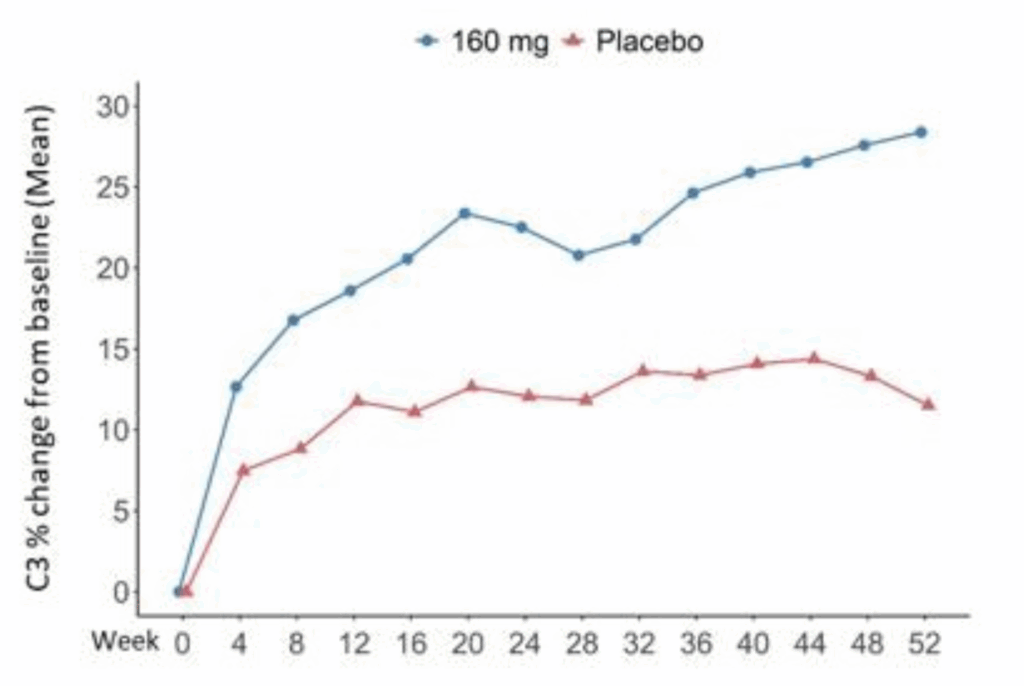
C3レベル:
- Telitacicept群: 26.98%(95% CI: 16.06~37.90)
- Placebo群: 10.08%(95% CI: −1.54~21.70)
- 差: 16.90%(95% CI: 2.14~31.66)
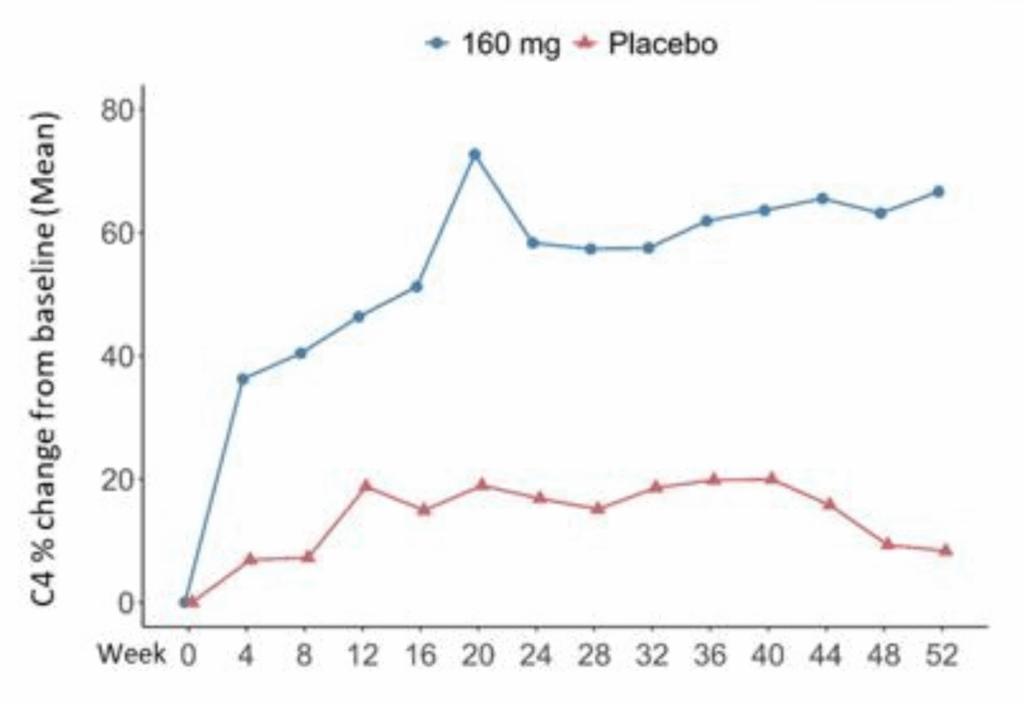
C4レベル:
- Telitacicept群: 57.73%(95% CI: 43.96~71.50)
- Placebo群: −0.01%(95% CI: −14.67~14.65)
- 差: 57.75%(95% CI: 39.13~76.36)
抗dsDNA抗体: 抗dsDNA抗体陽性の参加者の割合(各施設の検査基準による):
- Telitacicept群: 89.5%(145/162人)
- Placebo群: 84.0%(137/163人)
陽性から陰性への変化はまれ:
- Telitacicept群: 6人
- Placebo群: 1人
逆に、ベースラインで陰性だった参加者が後に陽転化:
- Telitacicept群: 11人
- Placebo群: 25人
- Limitationにもあるが、本試験では抗ds-DNA抗体のTitorはフォローされていないため、低下したかは判断できない
SLE再発までの時間(中央値):
- Telitacicept群: 198日
- Placebo群: 115日
- ハザード比: 0.57(95% CI: 0.44~0.74)
尿蛋白: ベースラインで尿蛋白レベルが上昇していた参加者のうち、52週時点で0.5g/24時間以下または0.5g/24時間以上の減少を示した割合:
- Telitacicept群: 71.8%
- Placebo群: 55.1%
- 差: 16.7パーセントポイント(95% CI: 3.8~30.0)
SRI-5〜8:
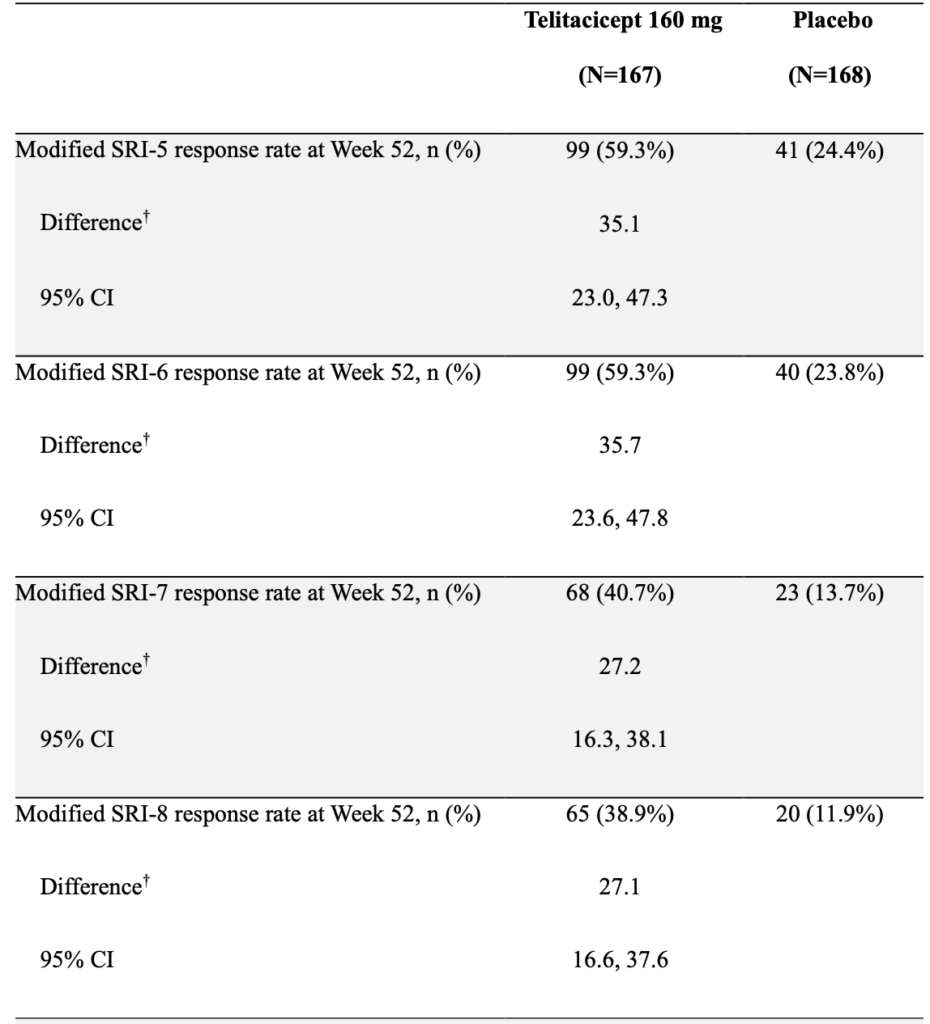
BILAG indexでA(重度)スコアまたは2つ以上のB(中等度)スコアの新規疾患活動性がない
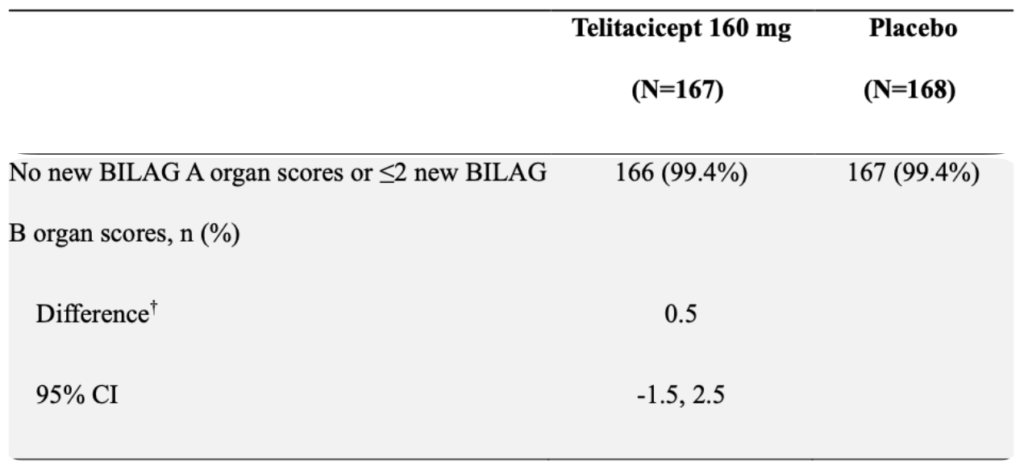
BILAGの各群の改善率
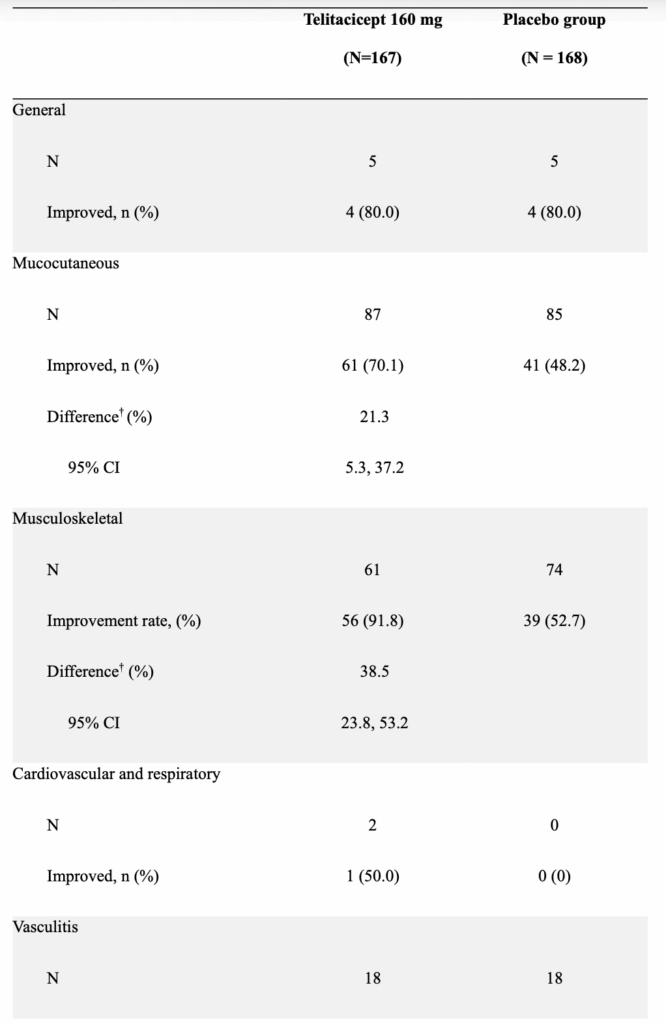
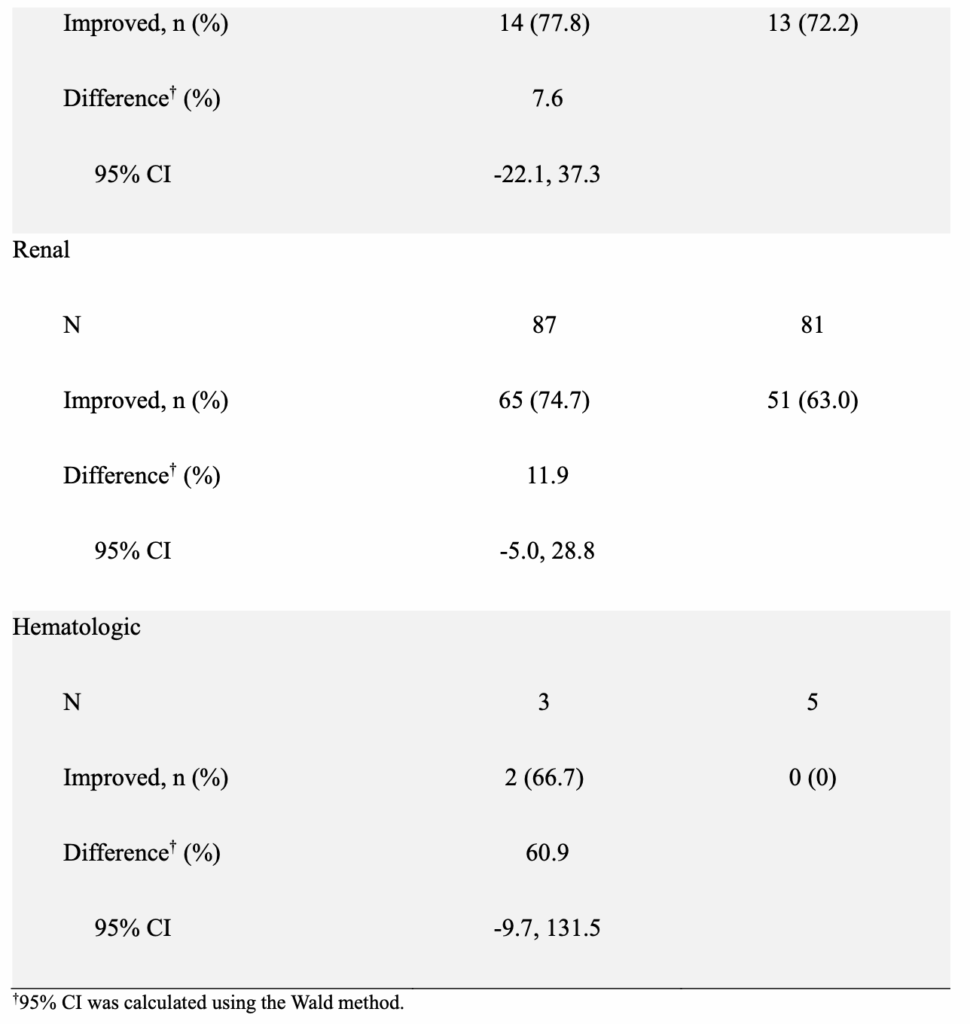
- 主要評価項目であるmSRI-4は、SLEDAI・BILAG・PGAの3つの複合指標であるが、PGAとBILAGは両群で同等に満たすため、主なSRI-4の違いは、SLEDAIの低下によって生じていることが分かる。
- BILAGも、mSRI-4の基準では著変がないが、臓器障害が改善した患者はtelitacicept群で多いようにみえ、mSRI-4と同様にSLEDAI・BILAG・PGAの3つを用いた複合指標であるBICLAでの評価でも、telitacipect群でよい結果を残しそうではある(あくまで筆者の推測)
安全性
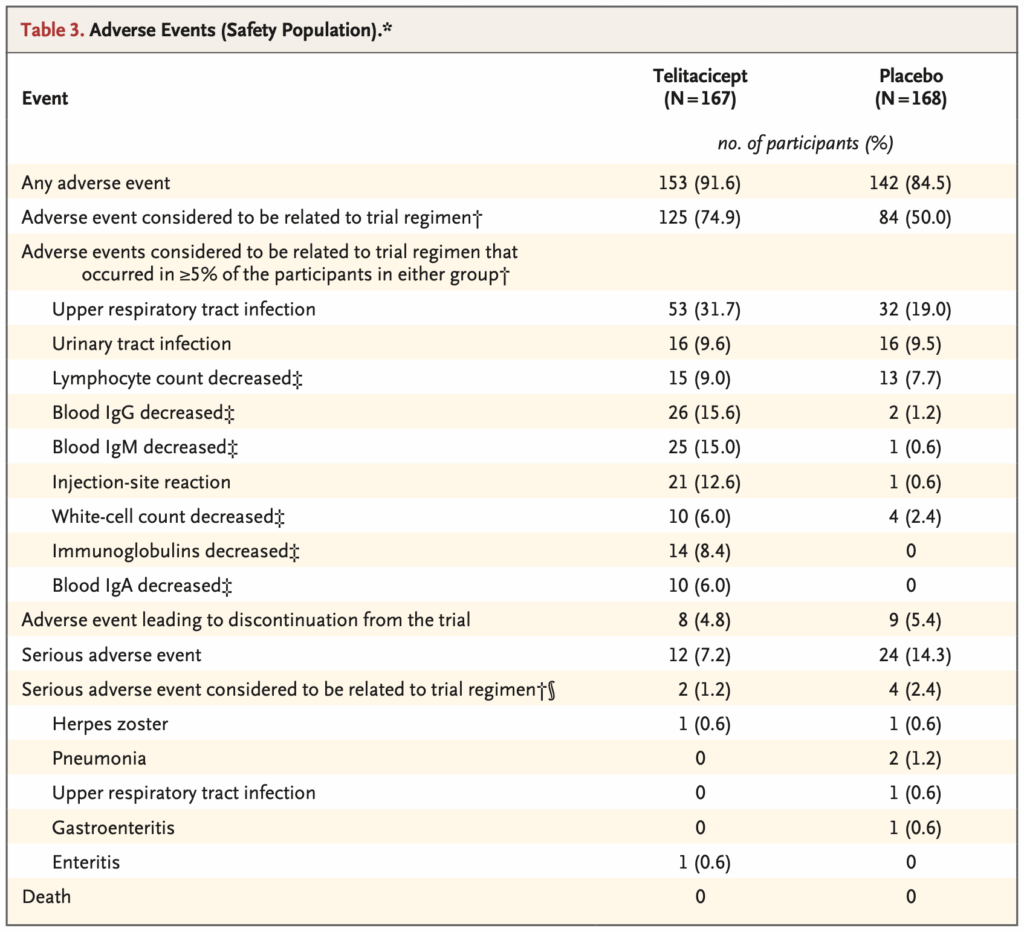
少なくとも1つの有害事象:
- Telitacicept群: 91.6%
- Placebo群: 84.5%
ほとんどの事象は軽度から中等度だった。
試験治療に関連すると研究者が判断した有害事象:
- Telitacicept群: 74.9%
- Placebo群: 50.0%
Telitacicept群で試験治療に関連すると考えられた最も一般的な有害事象:
- 上気道感染: 31.7%(placebo群19.0%)
- 血中IgG減少: 15.6%(placebo群1.2%)
- 血中IgM減少: 15.0%(placebo群0.6%)
- 注射部位反応: 12.6%(placebo群0.6%)
注射部位反応のほとんどは軽度または一過性だった。
重篤な有害事象:
- Telitacicept群: 7.2%
- Placebo群: 14.3%
Telitacicept群で試験治療に関連すると判断された重篤な有害事象:
- 2人(帯状疱疹1人、腸炎1人)
Placebo群で試験治療に関連すると判断された重篤な有害事象:
- 4人(肺炎2人、帯状疱疹・上気道感染・胃腸炎各1人)
死亡: なし
中和抗体:
- Telitacicept投与者1人が24週時点で中和抗体陽性
Discussion
結果の解釈
中等度から重度のSLE患者を対象としたこの第3相二重盲検ランダム化対照試験において、中国の参加者では、標準療法にtelitacicept追加投与した場合、プラセボに標準療法を追加した場合と比較して、52週時点でmodified SRI-4反応を示した患者数が有意に高かった。
TelitacicceptはTACIとIgG Fc断片の融合タンパク質で、BLySとAPRILシグナル伝達を遮断する。この機序はbelimumab(BLyS)の標的と重複し、それを超えて拡張している。この二重標的化の真の効果は不明だが、APRILとB細胞成熟抗原の阻害は形質細胞形成と自己抗体産生を阻害する可能性がある。
Belimumabとの比較: SLE患者の多様な集団を対象とした2つの国際的belimumab試験では、52週時点でのSRI-4反応率は43.2~57.6%(プラセボ33.5~43.4%)だった。中国人患者が大多数を占める別のbelimumab試験では、52週時点のmodified SRI-4反応率は53.8%(プラセボ40.1%)だった。本試験のtelitacicceptでは67.1%(プラセボ32.7%)の参加者がmodified SRI-4反応を示した。しかし、直接比較のランダム化試験なしには、telitacicceptとbelimumabの相対的有効性について結論を出すことはできない。
プラセボ反応率について: 一部のループス症状(特に腎ループスと血管炎)で観察されたプラセボ反応率が比較的高いのは、平均への回帰、試験中のバックグラウンド治療の慎重な使用、場合によっては期待バイアスの組み合わせによるものと考えられる。本試験では腎炎患者の割合が高かったため、この疾患に必要なバックグラウンド治療により時間とともに改善が期待されるが、これらの改善は臓器障害の蓄積を防ぐには不十分である。
Ataciceptとの比較: BLySとAPRILの別の二重阻害剤であるatacicept(アタシセプト)は、SLE患者を対象に研究されており、結果は一貫していない。ループス腎炎患者を対象とした試験(ataciceptまたはプラセボをmycophenolate mofetilに追加)は、3人の参加者がIgGレベルの急激な低下と重篤な感染症を起こしたため中止された。第3相APRIL-SLE試験では、肺胞出血を伴う肺感染症による2件の死亡後、atacicept 150mg群への登録が中止された。
感染リスクに対処するため、SLE患者を対象としたatacicept phase 2b ADDRESS II試験では、スクリーニングデータの医学的モニターレビューによる試験適格性の確保とワクチン接種の要件を含む軽減戦略を使用した。その試験では、安全性はatacicept群とplacebo群で同様で、24週時点のSRI-4反応率はatacicept群で53.8~57.8%(placebo群44.0%)だった。反応の可能性は長期延長研究を通じて維持された。
Limitation
- 中国人のみが参加したため、結果の一般化可能性に影響を与える可能性がある
- 重度の腎または中枢神経系病変を有する人は除外された
- Telitacicept群でplacebo群よりも多くの参加者がグルココルチコイドを減量したが、これは試験要件ではなかったため、医師がベースライン用量を維持することを選択した可能性がある
- Telitacicceptの機序を考えると、抗dsDNA抗体価は治療により減少することが期待されたが、各センターの検査室のアッセイカットオフに基づいて陽性または陰性としてのみ報告されたため、抗体価を決定することができなかった
- 試験は2019年10月から2022年4月の間に実施され、その間に世界的なCOVID-19パンデミックが患者保持にある程度影響を与えた(telitacicept群10人、placebo群8人が同意撤回または追跡不能)
- 患者の脱落率は予想より高かったが、両群で発生したため、結果に偏りをもたらした可能性は低い
- 副次評価項目について、多重比較調整が実施されていないため、これらの統計学的解析が行われていない
- グルココルチコイドのプロトコル上での記載が不明確
- 脱落率はいずれの群でも想定より高かった。いずれの群でも高かったため、結果に偏りをもたらした可能性は低いと本文では記載されているが、そう言い切れるだろうか。
- それぞれで脱落した群の理由が異なれば、結果に影響を与えると考えるが。確かに感度解析でも同様の結果は得られてはいる。
臨床への影響
腎・中枢神経ループスを除く、SLEに患者に対して、標準治療にtelitacicceptを加えることで臨床的改善が得られる可能性がある。



コメント