Trial of Anifrolumab in Active Systemic Lupus Erythematosus
E.F. Morand, R. Furie, Y. Tanaka, I.N. Bruce, A.D. Askanase, C. Richez, S.-C. Bae, P.Z. Brohawn, L. Pineda, A. Berglind, and R. Tummala, for the TULIP-2 Trial Investigators
N Engl J Med 2020;382:211-21.
Introduction
背景
- 全身性エリテマトーデス(SLE)に対する疾患特異的治療薬としてbelimumabが承認されているが、患者は通常、免疫抑制剤とグルココルチコイドで治療される。
- SLE治療薬の開発は、末梢血遺伝子発現シグネチャーの多様性を含む臨床的・生物学的不均一性によって制限があった。これらは臨床試験デザインと評価項目選択における課題となり、SLE臨床試験の失敗の原因になった可能性がある。
- I型interferon経路がSLEに関与しているというエビデンスがある。
わかっていること
- I型interferon経路の阻害による治療効果がanifrolumabのphase 2試験で報告された
- Anifrolumabは完全ヒトIgG1κモノクローナル抗体で、I型interferonレセプターサブユニット1に対する抗体であり、すべてのI型interferonによるシグナル伝達を阻害する
- Phase 2試験では、Systemic Lupus Erythematosus Responder Index(SRI)とBritish Isles Lupus Assessment Group(BILAG)-based Composite Lupus Assessment(BICLA)を含む複数の評価項目で効果が示された
- 最初のphase 3試験(TULIP-1)では、SRI(4)の主要評価項目で有意な効果を示さなかった。ただし、BICLA反応を含む一部の事前規定副次評価項目ではanifrolumab治療が有効であった。
- Phase2 trial =MUSE trial =Arthritis Rheum 2017;69:376-86.
わかっていないこと
- BICLAを主要評価項目とした場合のanifrolumabの効果は分かっていない
今回の研究目的
- 活動性SLEにおけるanifrolumabの2番目のphase 3試験(TULIP-2)を実施する。最初のphase 3試験の副次評価項目であったBICLAを主要評価項目として使用する。
Method
16カ国119施設で実施された国際多施設共同研究(2015年7月から2018年9月にかけて実施)
研究デザイン
Phase 3、無作為化、二重盲検、プラセボ対照、並行群間試験
Inclusion criteria
- 18~70歳
- 同意の24週前に、1982年American College of Rheumatologyの分類基準を満たすSLE患者
- ただし以下のうち1つは必ず満たす
- 抗核抗体 ≥ 1:80 または
- 抗ds-DNA抗体 or 抗Sm抗体が陽性
疾患活動性:以下の3項目をすべて満たす
- SLEDAI系統
- SLEDAI-2K ≧6(発熱、ループス関連頭痛、器質的脳症候群によるポイントを除く)
- Clinical SLEDAI-2K ≧4 (尿所見や免疫学的測定を含むいかなる検査所見に起因する点数を含めない SLEDAI-2K )
- いずれのSLEDAIも以下の様に定義する
- (i) 次の臨床コンポーネントに由来する点数は含める:関節炎、筋炎、皮疹、脱毛、粘膜潰瘍、胸膜炎、心膜炎、血管炎。
- (ii) 発熱、SLE 頭痛、器質性脳症候群に起因する点数は除外する。
- BILAG 2004 で1つ以上の臓器に重度の疾患活動性(≥1 A項目)または2つ以上の臓器に中等度の活動性(≥2 B項目)
- Physician Global Assessment(PGA)スコア1以上(0~3のスケール)
併用治療:
- スクリーニング時に以下の少なくとも1つで安定した治療を受けている:
- プレドニゾン(≦40mg) 組み入れ2週間前は一定であること
- 以下は組み入れ8週間前に投与が一定であること
- 抗マラリア薬
- アザチオプリン ≦200mg/day
- ミゾリビン ≦150mg/day
- ミコフェノール酸モフェチル ≦2000mg・ミコフェノール酸
- メトトレキサート ≦25mg/week
Exclusion criteria
- 活動性の重症ループス腎炎
- ANIより強力な治療が必要と考えられる場合
- 重症または不安定な神経精神性SLE
- 患者がこれによってICを理解できない、または主治医によってANIより強力な治療が必要と判断される場合
- C-SSRS(Columbia Suicide Severity Rating Scale)による、過去6ヶ月以内の自殺念慮(重症度4・5)
介入
Anifrolumab群:
- 静脈内投与でanifrolumab 300mgを4週ごとに48週間投与
投与スケジュール:
- 4週ごとに48週間(合計13回投与)
併用治療:
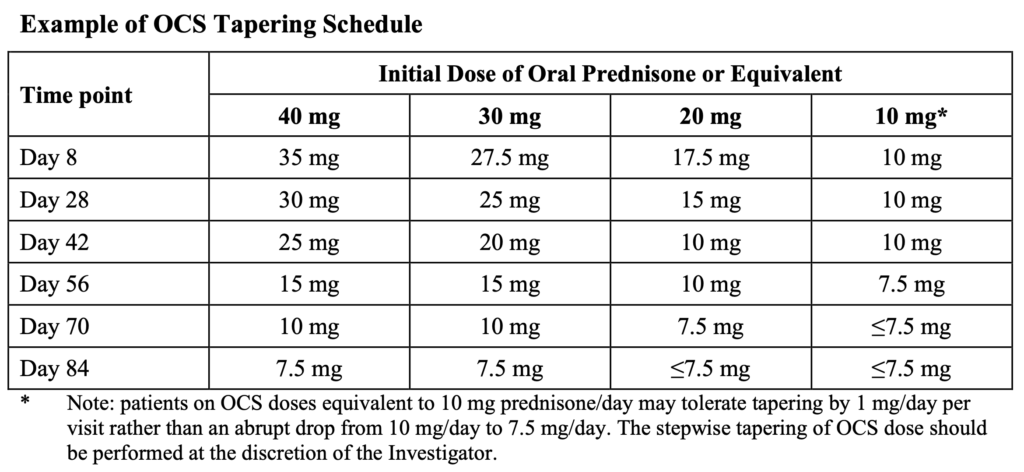
- グルココルチコイド(OCS)
- (組み入れ前は40mg以下で2週間内服量は一定)
- 減量について
- ベースラインのOCS ≥10.0 mg/日のすべての患者において、目標OCS用量 ≤7.5 mg/日への減量を絶対に試みなければならない
- 減量はWeek 8に開始し、以下のいずれかの基準を満たす場合を除き、目標用量に到達するまで段階的に継続する。
- 主要臓器系(腎、中枢神経、心肺、血管炎、発熱、血小板減少、溶血性貧血、または消化管活動性)において、SLEDAI-2Kの活動性がベースラインより悪化している。
- SLEDAI-2Kに基づき新たに罹患した臓器系がある(ただし血清学的異常〔抗dsDNA抗体、低補体血症〕は除外する)。
- CLASI活動性スコア ≥10で示される中等度~重度の皮膚病変がある。
- 圧痛関節および/または腫脹関節の活動関節数 ≥8で示される中等度~重度の関節炎がある。
- 推奨されるステロイド減量レジメンは付録 I(Appendix I)に示すが、各来院時におけるOCS用量の減らし方には一定の裁量を治験担当医師に認める。適格患者で減量を試みない場合は、スポンサー(または指定代理人)へ直ちに連絡しなければならない。
- 治験担当医師は義務ではないが、疾患活動性に基づき、Week 40 までは目標の7.5 mg/日を下回る水準へのさらなる減量を継続してもよい。もし減量に続発して疾患活動性が増加した場合、Week 8~Week 40の間はベースラインのOCS用量を上限として増量してもよく、この間における以後の疾患活動性評価では非レスポンダーとはみなさない。一方、ベースライン用量を超えるOCSが必要となった患者は試験継続は可能だが、以後の疾患活動性評価では非レスポンダーとみなす。
- Week 40以降のステロイド減量は認めない。
- グルココルチコイド以外は、他の治療は試験を通じて一定
Control
Placebo群:
- 静脈内投与でプラセボを4週ごとに48週間投与
- 投与スケジュールと併用治療の規定はanifrolumab群と同じ
主要アウトカム
52週時点でのBICLA反応率
BICLA反応の定義(以下のすべてを満たす):
- ベースライン時の重度(BILAG-2004 A)または中等度(BILAG-2004 B)の疾患活動性すべてがより低いレベル(A→ B、C、DおよびB→ C、D)に軽減
- 他の臓器系で悪化がない(悪化の定義:≥1つの新規BILAG-2004 A項目または≥2つの新規BILAG-2004 B項目)
- SLEDAI-2Kスコアで疾患活動性の悪化がない(ベースラインからの増加なし)
- PGAスコアで悪化がない(ベースラインから0.3ポイント以上の増加なし)
- 試験治療の中止なし
- プロトコルで許可された閾値を超える制限薬剤の使用なし
プロトコル改訂: データの非盲検化前、ただし最初のphase 3試験完了後のプロトコル改訂により、主要評価項目をSRI(4)からBICLA反応に変更した。この変更は最初のphase 3試験からの情報に基づいた。TULIP-2試験のデータは主要または副次評価項目の変更を通知するために使用されなかった。
副次アウトカム
主要副次評価項目(多重比較調整あり):
- ベースライン時に高interferon遺伝子シグネチャーを有する患者での52週時点のBICLA反応(プロトコル改訂によりSRI[4]から変更)
- グルココルチコイド減量:ベースライン時に10mg/日以上服用していた患者で、40週から52週まで7.5mg/日以下への減量維持
- 皮膚病変の改善:ベースライン時に中等度から重度の皮膚活動性(CLASI≥10)を有する患者での12週時点でのCutaneous Lupus Erythematosus Disease Area and Severity Index(CLASI)の50%以上の減少
- 関節症状の改善:ベースライン時に腫脹関節6個以上かつ圧痛関節6個以上(28関節で評価)の患者での52週時点での腫脹関節数と圧痛関節数の両方の50%以上の減少
- 再発率:52週までの年間再発率
- 再発の定義:前回の訪問と比較して≥1つの新規BILAG-2004 A項目または≥2つの新規BILAG-2004 B項目)
その他の副次評価項目(多重比較調整なし):
- 52週時点でのSRI(4)~SRI(8)反応
- それぞれ、
- SLEDAI-2Kスコアの≥4ポイント~≥8ポイントの減少 と以下をすべて満たす
- BILAG-2004で評価される新規臓器系の障害やPGAの悪化なし
- 試験治療の中止なし
- プロトコルで許可された閾値を超える制限薬剤の使用なし)
- 初回再発までの時間
- 52週まで持続したBICLA反応の発現までの時間
安全性評価:
- 有害事象
- 検査値評価
- バイタルサイン
- 特に注目すべき有害事象:重症感染症、日和見感染症、アナフィラキシー、がん、帯状疱疹、結核、インフルエンザ、非SLE関連血管炎、判定された主要心血管イベント
薬力学的評価:
- I型interferon遺伝子シグネチャーの薬力学的中和評価
血清学的評価:
- 抗dsDNA抗体
- 補体(C3、C4、CH50)
- 抗薬物抗体
解析方法
解析対象集団: 無作為化され、anifrolumabまたはプラセボを少なくとも1回投与されたすべての患者(modified intention-to-treat集団)
主要評価項目の解析:
- 以下の要素による層別化Cochran-Mantel-Haenszel検定を使用
- SLEDAI-2Kスコア
- ベースのグルココルチコイド投与量
- I型interferon遺伝子シグネチャー)
- 試験治療を中止した患者は、その後のすべての訪問でBICLA反応なしと分類
- 間欠的欠測データ(例:訪問漏れ)の取り扱い:
- 1回の訪問については最終観測値繰越(LOCF)で補完
- 連続して2回以上訪問を逃した場合は非反応として補完
- 52週のBICLAデータ欠測:週48の反応が利用可能であればそれを使用、週48も欠測の場合は非反応として補完
- 感度分析:間欠的欠測データに対する多重代入法を使用
報告方法:
- 反応した患者の実数を反応率とともに報告
- 信頼区間はCochran-Mantel-Haenszel法で調整
主要副次評価項目の解析:
- 主要評価項目と同様に解析
- ただし再発率は負の二項回帰モデルを使用
- 追跡期間をオフセット変数としてモデルに組み込み、患者ごとの異なる曝露時間を調整
多重比較の調整:
- 事前に決定された重み付けを用いたweighted Holm法を使用して、主要評価項目と主要副次評価項目全体で家族単位の第1種過誤率を0.05で制御
- この方法は、事前定義された重みに従って0.05のαを分割し、最初の帰無仮説棄却後、対応するαをこれらの重みに比例して再利用する
- 重みは推定検出力と相対的臨床的重要性に基づいて選択:
- ベースライン時に高interferon遺伝子シグネチャーを有する患者でのBICLA反応(0.8)
- グルココルチコイド減量(0.06)
- CLASIの減少(0.06)
- 腫脹関節と圧痛関節の数の減少(0.06)
- 年間再発率(0.02)
その他の事前規定副次評価項目:多重比較調整を実施せず
時間-イベント解析:
- 52週まで持続したBICLA反応の発現までの時間と初回再発までの時間をCox比例ハザードモデルで評価
安全性解析:
- anifrolumabまたはプラセボを少なくとも1回投与されたすべての患者を対象に記述的に解析
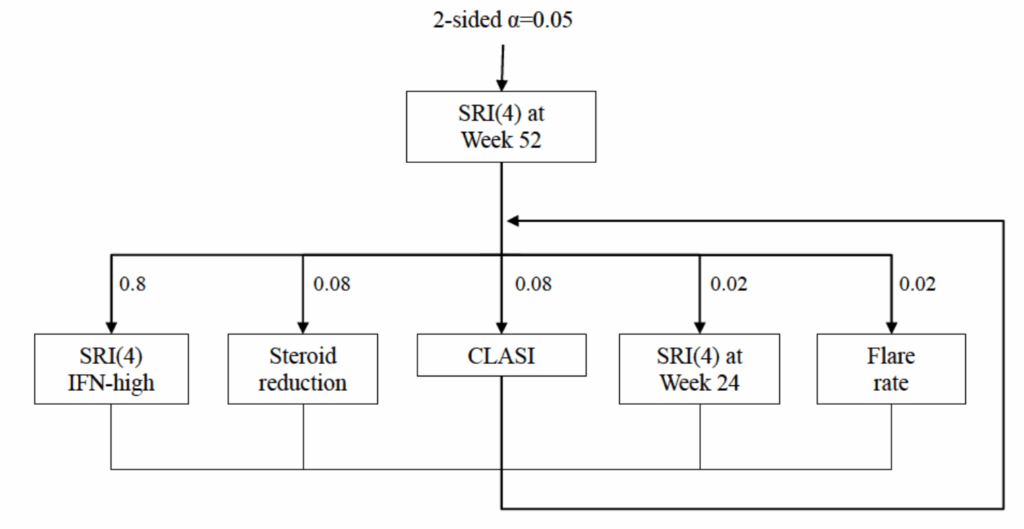
- weighted Holm法による多重比較について
- 実施する意味
- 通常1つの検定は有意水準α=0.05(5%)で行う。
- 10個の項目について別々に実施した場合、偶然有意で判定される可能性は40%になる
- 今回は主要評価項目5つについては、多重比較調整を行うことで、5つの検定全体でα=0.05(5%)とすることができる
- 具体的な方法
- まず評価したい5項目について臨床的な重要性によってα=0.05を重み付けを行う
- 具体的には、SRI(4)>>GC減量=CLASI減少=関節数減少>年間再発率
- それぞれで0.05を分割し、例えばSRI(4)なら、α=0.04(=0.05×0.8)で有意と見なす
- 前述のα値を用いて、最も重要な項目から順に検定する。
- 有意であると検定された項目までは有意と見なせる。ある1項目で有意でないと判定された場合には、それ以降の項目は有意とは見なせない。
Result
研究対象者
ベースライン特性:
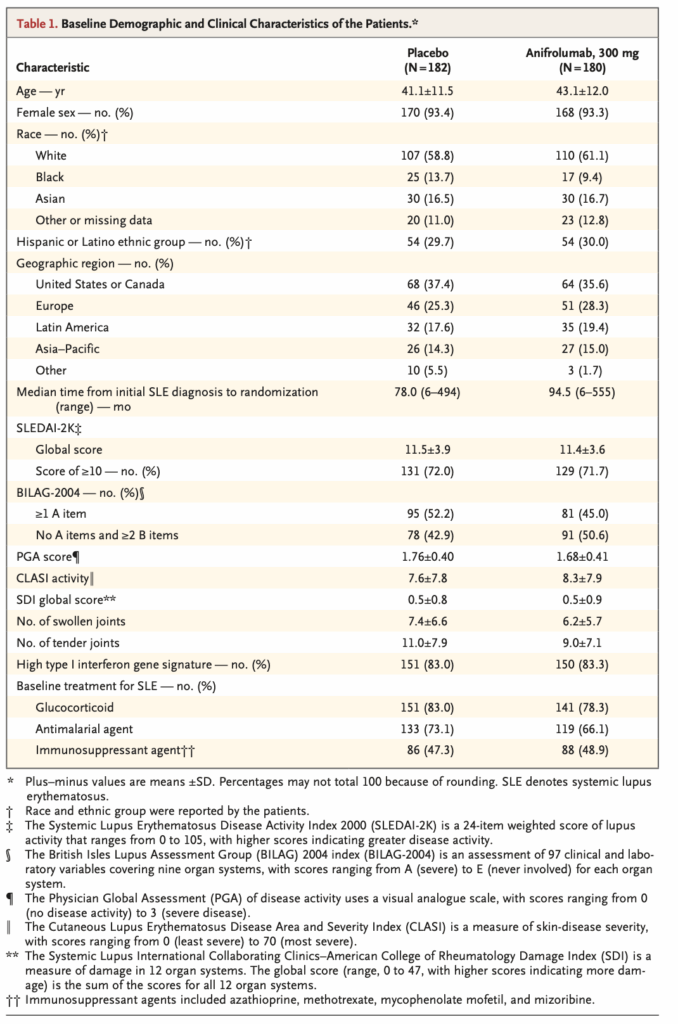
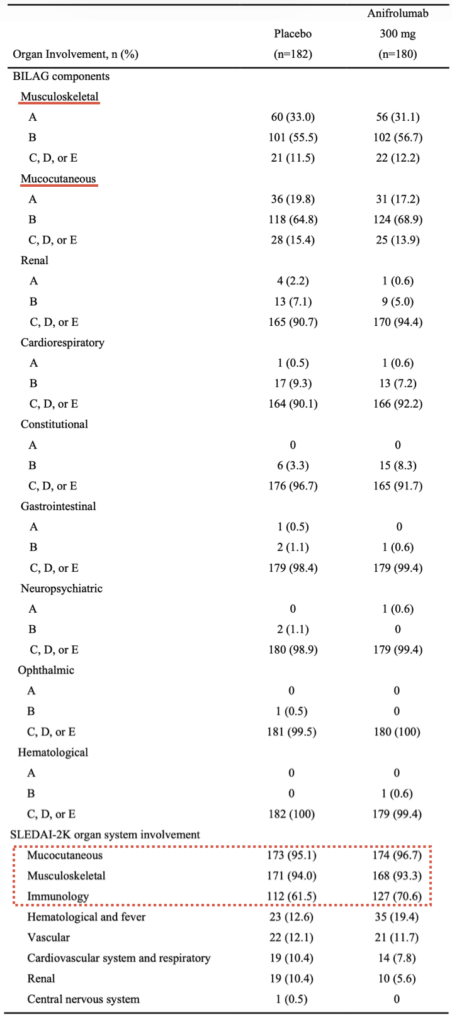
- SLE初診断から無作為化までの期間中央値:Placebo群78.0ヶ月、Anifrolumab群94.5ヶ月
- 組み入れ24週間までにSLEと診断されることがInclusion criteriaのため、罹患してからが長い患者層
- 疾患活動性
- SLEDAI-2K 11.5点程度(BLISSで10点程度)
- 粘膜・筋骨格(95%)>免疫学的(70%)>>血液学的・発熱・血管(12%程度)>>>ほか
- BILAG 1A:50%程度/2Bのみ:50%程度(BLISSではBILAG 1A/2Bが60%程度)
- BILAG 1A/2Bあるのは、ほぼ筋骨格・粘膜のみ
- 腫脹関節:6〜7、圧痛関節:10程度と関節炎が強い
- 高I型interferon遺伝子シグネチャー:Placebo群83.0%(151/182)、Anifrolumab群83.3%(150/180)
- SLEDAI-2K 11.5点程度(BLISSで10点程度)
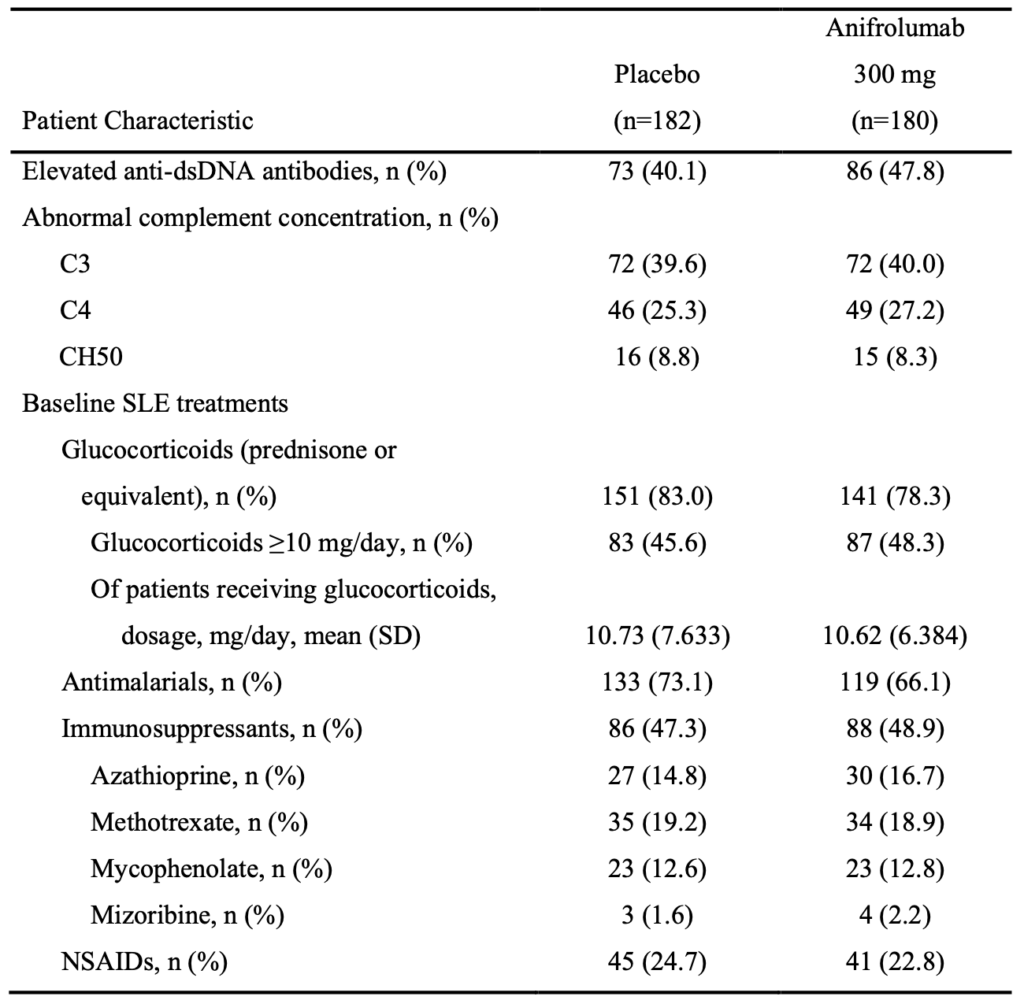
- 治療介入
- グルココルチコイド使用量は80%程度とおく、50%程度が10mg/day以上で使用している
- 抗マラリア薬は70%程度、免疫抑制薬は50%程度で、グルココルチコイド+HCQ、グルココルチコイド単剤群もある程度存在すると考えられる
主要評価項目
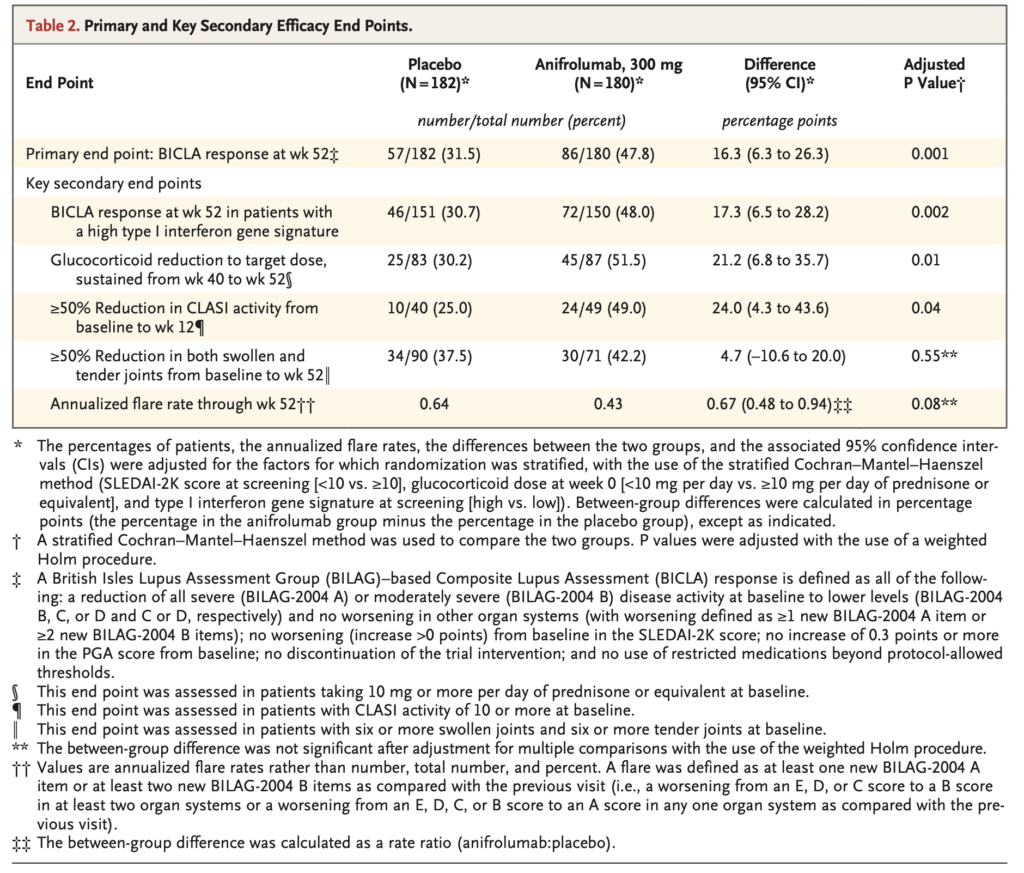
52週時点でのBICLA反応率:
- Anifrolumab群:47.8%(86/180)
- Placebo群:31.5%(57/182)
- 調整後差:16.3 percentage points(95% CI: 6.3-26.3)P=0.001
主要副次評価項目
高interferon遺伝子シグネチャー患者でのBICLA反応(52週):
- 対象:301名(全体の83.1%)
- Anifrolumab群:48.0%(72/150)
- Placebo群:30.7%(46/151)
- 調整後差:17.3 percentage points(95% CI: 6.5-28.2)調整後P=0.002
グルココルチコイド減量(週40-52で7.5mg/日以下維持):
- 対象:ベースライン時に10mg/日以上服用していた患者170名(全体の47.0%)
- Anifrolumab群:51.5%(45/87)
- Placebo群:30.2%(25/83)
- 調整後差:21.2 percentage points(95% CI: 6.8-35.7)
- 調整後P=0.01
皮膚病変の改善(ベースライン時にCLASI≥10で、週12でCLASI 50%以上減少):
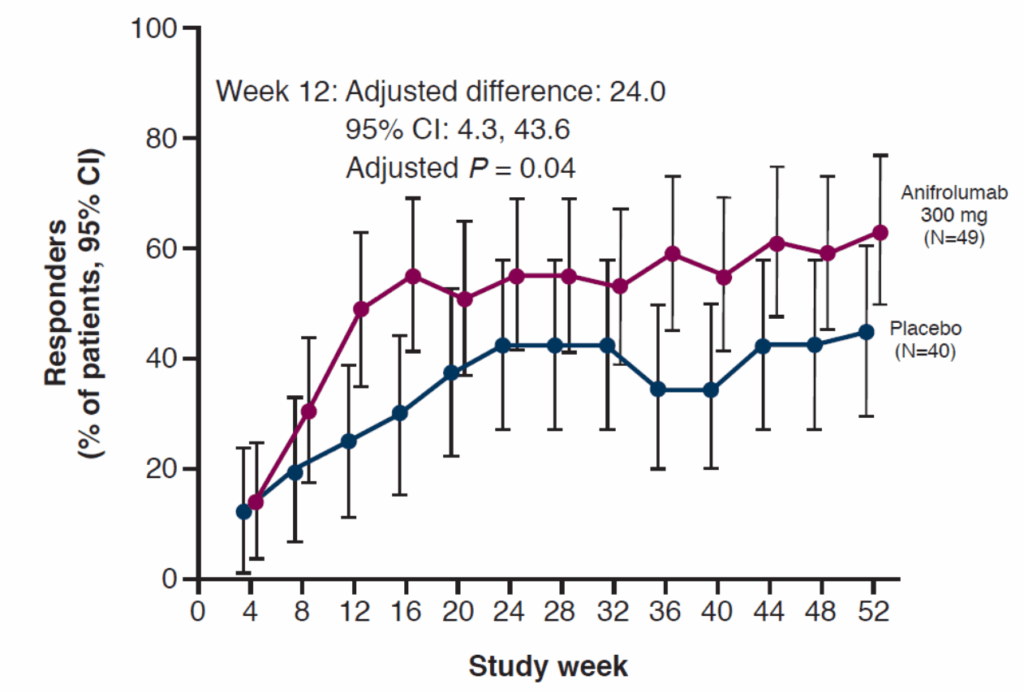
- Anifrolumab群:49.0%(24/49)
- Placebo群:25.0%(10/40)
- 調整後差:24.0 percentage points(95% CI: 4.3-43.6) 調整後P=0.04
関節炎の改善(52週で腫脹関節数・圧痛関節数とも50%以上減少):
- 対象:ベースライン時に腫脹関節6個以上かつ圧痛関節6個以上の患者
- Anifrolumab群:42.2%(30/71)
- Placebo群:37.5%(34/90)
- 調整後差:4.7 percentage points(95% CI: -10.6-20.0)P=0.55
年間再発率(52週まで):
- Anifrolumab群:0.43、Placebo群:0.64
- 調整後rate ratio:0.67(95% CI: 0.48-0.94)調整後P=0.08
- 前述のように、主要副次項目ではweighted Holm法による多重比較によって解析を行っている
- そのため、各評価において有意とするα値が異なることに注意が必要である
その他の副次評価項目(多重比較調整なし)
以下は多重比較調整を行っていないため、各P値を算出することは可能だが、統計学的解釈には注意が必要である。
経時的なBICLA反応率:
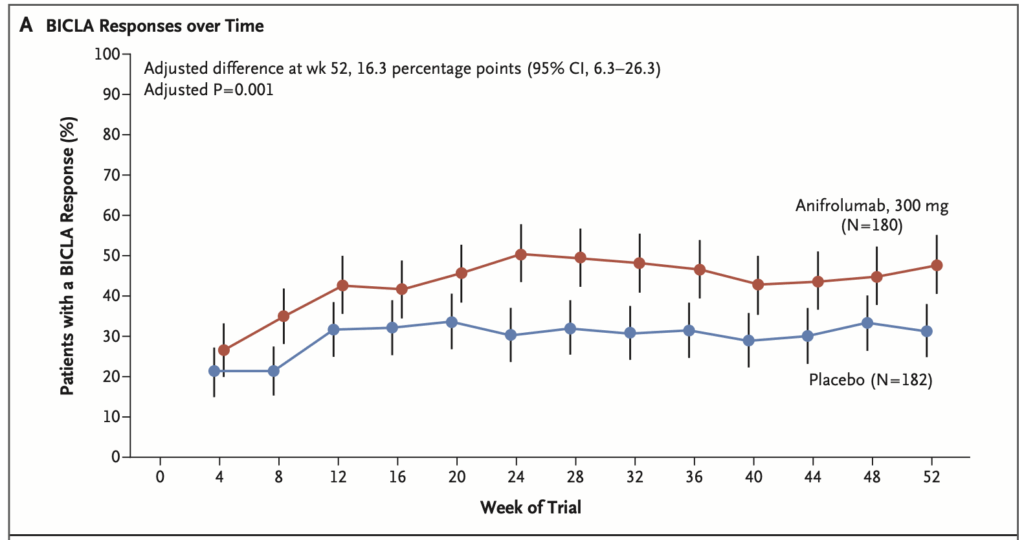
- すべての評価時点で示されている
- 感度分析(欠測データに対する多重代入法使用)でも同様の結果
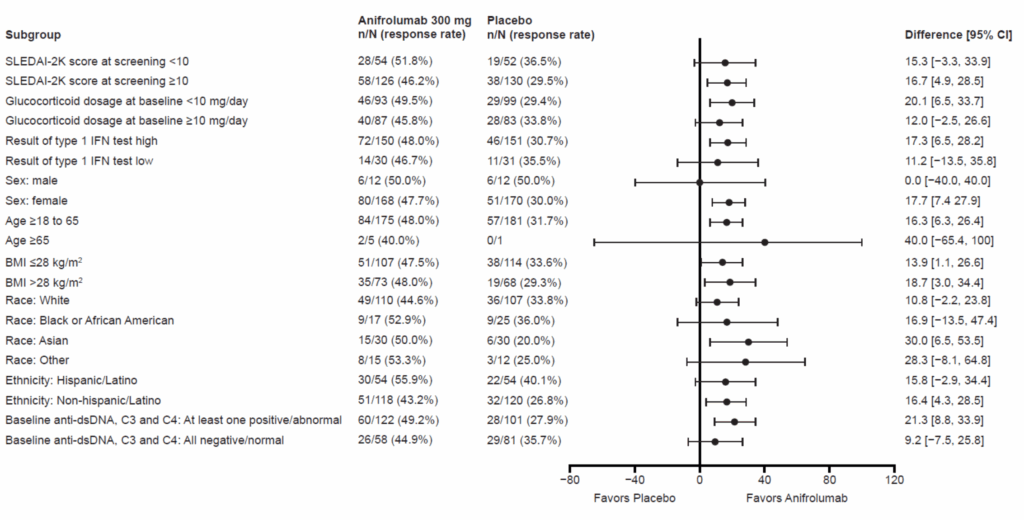
BICLA反応率のサブグループ解析:
- (統計学的に有意かは解釈できないが)1を跨いでいるのは以下のサブグループ
- SLEDAI-2K ≧10
- GCベースライン<10mg/day
- Type1 IFNが高値
- 女性
- 年齢 18〜65
- BMI >28
- アジア人
- 非ヒスパニック・ラテン人
- ベースラインの抗dsDNA抗体陽性・C3・C4異常値
52週まで持続したBICLA反応の発現までの時間:
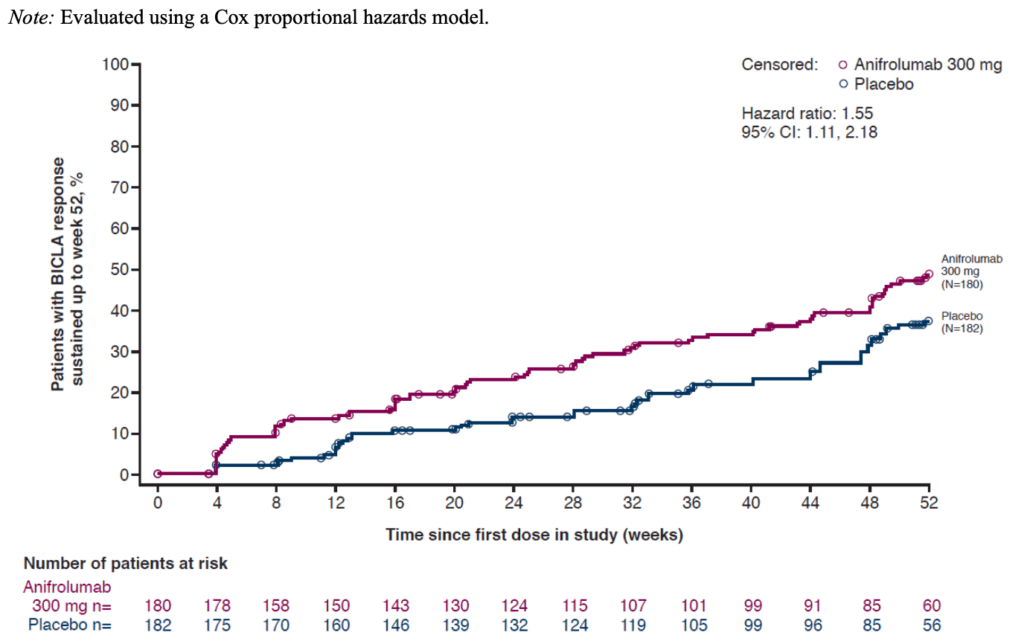
- 多重比較調整なし、統計学的推論不可
低interferon遺伝子シグネチャー患者でのBICLA反応:
- 対象:61名(全体の16.9%)
- Anifrolumab群:46.7%
- Placebo群:35.5%
- 調整後差:11.2 percentage points(95% CI: -13.5-35.8)
SRI(4)~SRI(8)反応、その他の評価項目:

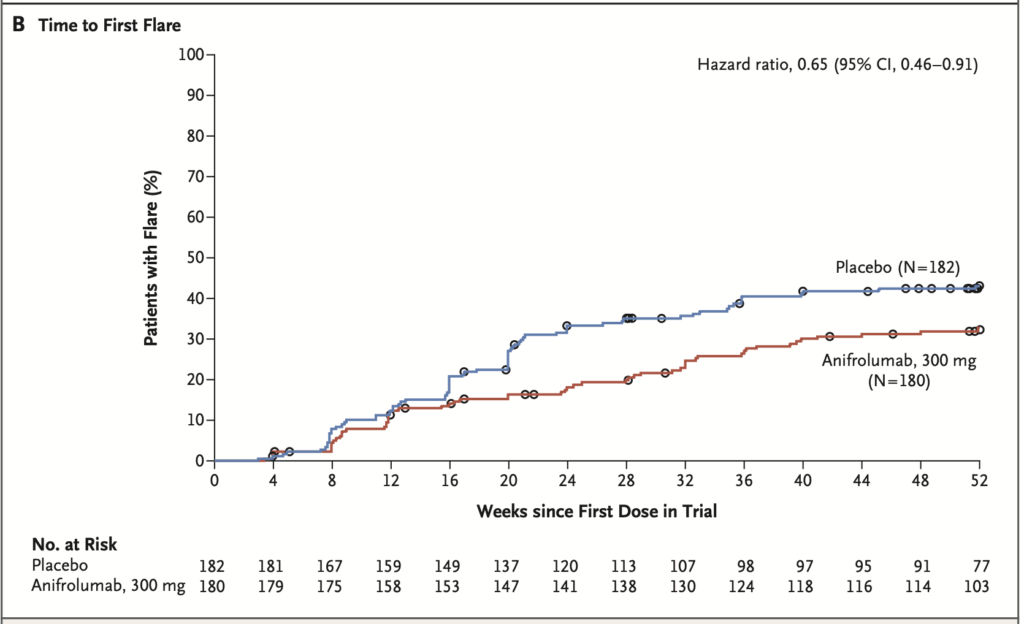
初回再発までの時間:
- Hazard ratio:0.65(95% CI: 0.46-0.91)
- Anifrolumab群で良好
I型interferon遺伝子シグネチャーの中和:
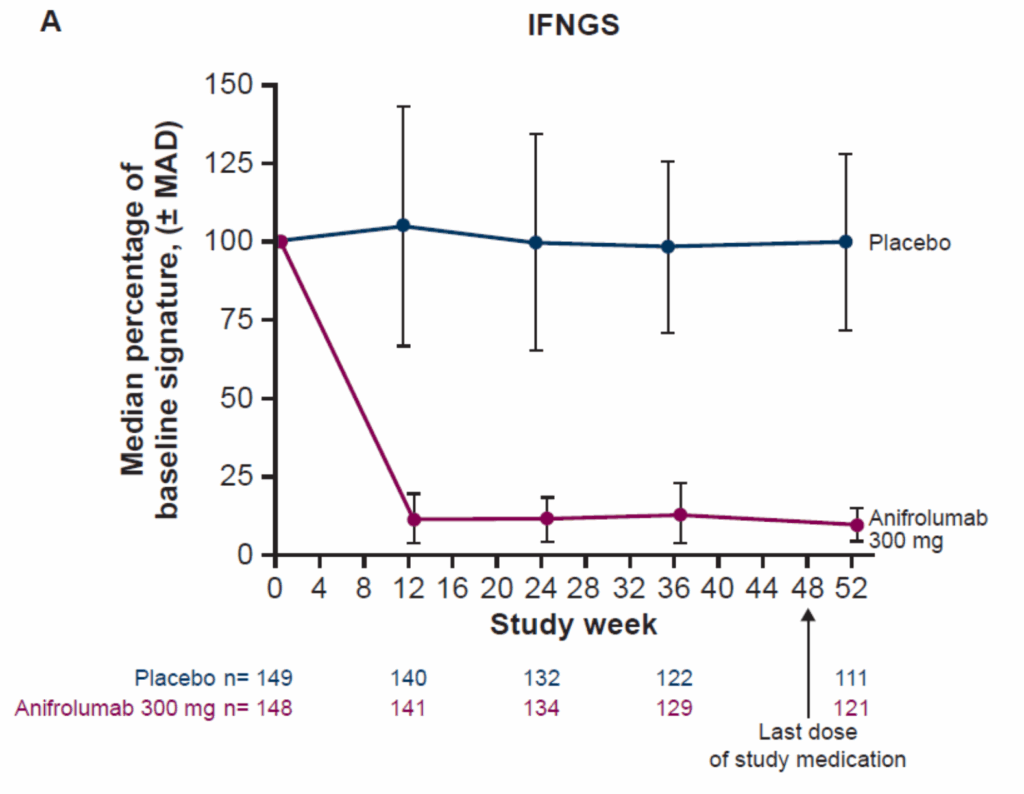
- ベースライン時に高interferon遺伝子シグネチャーを有しanifrolumabを投与された患者(150/180、83.3%)で、interferon遺伝子シグネチャーの中和が早期に達成され52週まで維持された
- Placebo群では中和は観察されなかった
抗dsDNA抗体とC3レベルの変化:
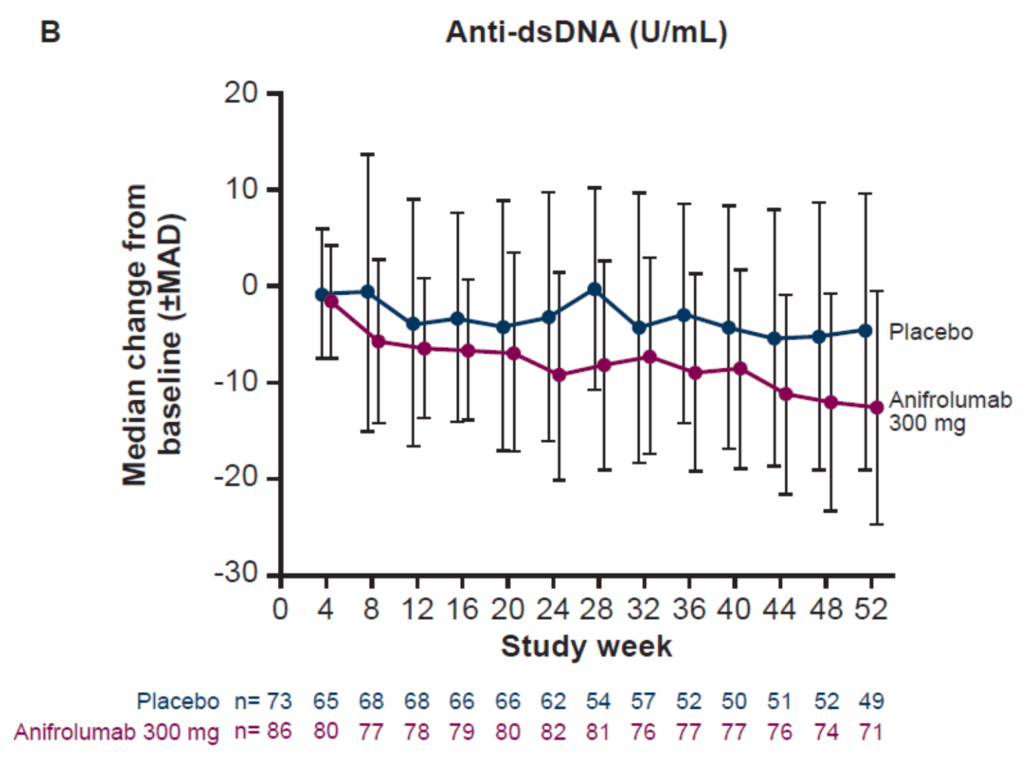
- ベースライン時に異常レベル(抗dsDNA抗体高値、C3低値)の患者での変化を評価
抗薬物抗体:
- Anifrolumab投与患者でベースライン時に抗薬物抗体陰性だった170名中、ベースライン後に陽性となったのは1名のみ(0.6%)
安全性
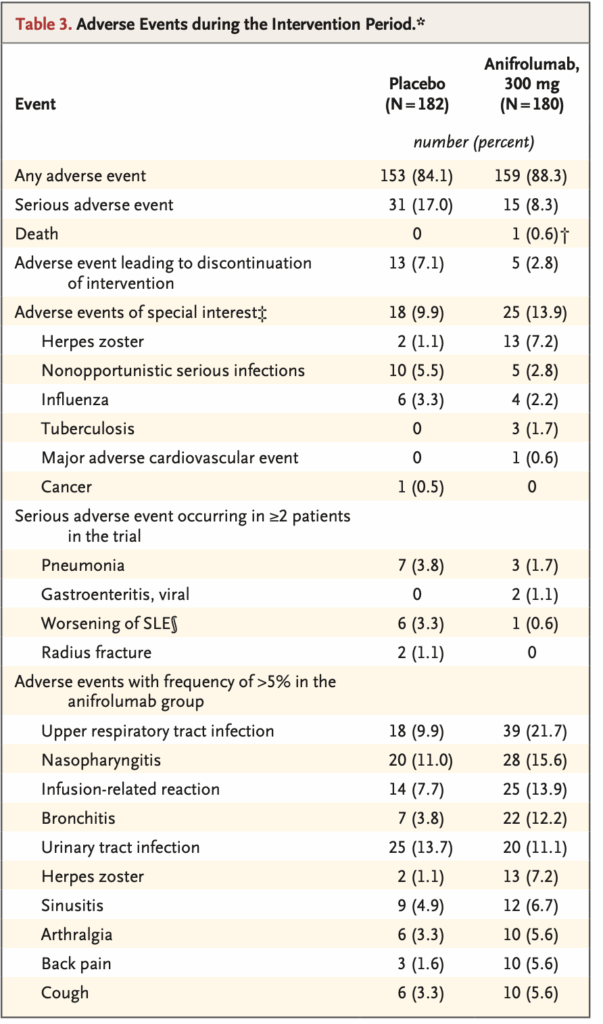
- Anifrolumab群で多い有害事象
- 帯状疱疹・上気道感染・気管支炎(インフルエンザはPlaceboの方が多い)
- 結核は3例、主要心血管イベント1例
Discussion
結果の解釈
- 結果
- TULIP-2試験において、月1回のanifrolumab投与により、placeboと比較して52週時点での複合エンドポイント(BICLA)による反応を示した患者の割合が高かった。これは類似のphase 3試験であるTULIP-1(異なる主要評価項目を使用)の結果とは対照的である。
- 3つのanifrolumab試験(MUSE、TULIP-1、TULIP-2)において、BICLA反応、CLASI、グルココルチコイド減量、再発減少については同様の点推定値がanifrolumab群で有利に示されたが、SRI(4)反応についてはMUSE試験とTULIP-2試験でのみ同様の点推定値が得られた。
- 本試験では、治療中止(これにより非反応と分類される)がplacebo群でより頻繁に発生し、その理由は効果不十分、有害事象の頻度上昇、同意撤回であった。
- 解釈
- BICLAはBILAG-2004に基づいており、臓器系内の部分的改善と完全改善の両方を記録できる。対照的に、SRI(TULIP-1試験の主要評価項目、SLEDAI基準)は特定項目内での完全な解決を必要とし、部分的改善を捉えることができない。
- 前臨床および橋渡し研究は、SLEの病因において自然免疫、特にI型interferonの異常活性化が役割を果たしていることを示唆している。anifrolumabの作用機序は、すべてのI型interferonサブタイプによるシグナル伝達に使用される共通受容体サブユニットを阻害する点で、以前研究された抗I型interferon抗体とは異なる。
- 以前研究された抗I型interferon抗体
- rontalizumab ・・・Ann Rheum Dis 2016;75:196-202.
- sifalimumab ・・・Ann Rheum Dis 2016;75:1909-16.
Limitation
- 本試験は、52週を超える効果の持続性やリスクを判定するようにデザインされていない。
- ベースラインで高interferon遺伝子シグネチャーを有しanifrolumabを投与された患者では、interferon遺伝子シグネチャーの抑制が観察されたが、この効果と臨床効果との間の推定上の関連性は調査されていない。
- ベースライン時に低interferon遺伝子シグネチャーを有する患者でもanifrolumab投与により臨床効果が観察されたが、このような患者の数は少ないため、このサブグループにおけるanifrolumabの効果については試験をまたいださらなる解析が必要である。
臨床への影響
- 活動性SLE患者において、anifrolumab(静脈内投与で4週ごとに300mg)は、52週間にわたり、placeboと比較して、疾患活動性を改善させ、グルココルチコイド減量効果を示し、皮膚病変を改善させた。
この論文の良い点
- 大規模な国際多施設共同研究で試験デザインが厳密:
- 16カ国119施設で実施され、結果の一般化可能性が高い
- Phase 3、無作為化、二重盲検、プラセボ対照の並行群間試験
- 独立した監視体制:
- 独立データ安全性監視委員会による安全性データの監視
- 独立中央評価グループによる疾患活動性評価
悪い点
- 主要評価項目の変更:
- 試験開始後、データの非盲検化前ではあるが、最初のphase 3試験(TULIP-1)完了後に主要評価項目をSRI(4)からBICLAに変更
- これは統計学的妥当性の観点から問題となり得る
- TULIP-1試験の結果に基づいて変更された
- 治療完遂率の群間差:
- Placebo群(71.4%)がanifrolumab群(85.0%)より治療完遂率が低い
- 中止理由として効果不十分、有害事象、同意撤回がplacebo群で多い
- これが結果に影響した可能性がある(informative censoring)
- 観察期間の限定:
- 52週までの評価のみで、長期的な効果の持続性や安全性については不明
- 低interferon遺伝子シグネチャー患者での評価不足:
- 全体の16.9%(61/362名)のみ
- バイオマーカーと臨床効果の関連性の未検証:
- Interferon遺伝子シグネチャーの中和と臨床効果の関連性が調査されていない
- Inclusion criteriaは特定のSLE患者のみに限定されていることには注意が必要
- 重症活動性ループス腎炎・NPSLEは除外されている
- ほとんどの臓器病変は粘膜・関節炎のみ
- GC・免疫抑制薬・HCQ等を使用して、安定している患者


コメント